La solubilidad se usa en química para describir las propiedades de un compuesto sólido que se mezcla y se disuelve completamente en un fluido sin dejar partículas sin disolver. Solo los compuestos iónicos (cargados) son solubles. Para fines prácticos, memorizar algunas reglas o consultar una lista de ellas es suficiente para indicarle si la mayoría de los compuestos iónicos se mantendrán sólidos cuando se dejan caer en el agua, o si se disolverá una cantidad significativa. En realidad, algunas moléculas se disolverán incluso si no puede ver el cambio, por lo que para experimentos precisos es posible que necesite saber cómo calcular esta cantidad.
Método uno de dos:
Usando reglas rápidas
-
 1 Aprende sobre los compuestos iónicos. Cada átomo normalmente tiene una cierta cantidad de electrones, pero a veces recogen un electrón extra o pierden uno a través de un proceso conocido como transferencia de electrones.[1] El resultado es un ion, que tiene una carga eléctrica Cuando un ion con una carga negativa (un electrón extra) se encuentra con un ion con una carga positiva (falta un electrón), se unen como los extremos negativo y positivo de 2 imanes. El resultado es un compuesto iónico.
1 Aprende sobre los compuestos iónicos. Cada átomo normalmente tiene una cierta cantidad de electrones, pero a veces recogen un electrón extra o pierden uno a través de un proceso conocido como transferencia de electrones.[1] El resultado es un ion, que tiene una carga eléctrica Cuando un ion con una carga negativa (un electrón extra) se encuentra con un ion con una carga positiva (falta un electrón), se unen como los extremos negativo y positivo de 2 imanes. El resultado es un compuesto iónico. - Se llaman iones con cargas negativas aniones, mientras que los iones con cargas positivas son cationes.
- Normalmente, la cantidad de electrones en un átomo es igual a la cantidad de protones, cancelando las cargas eléctricas.
-
 2 Comprender la solubilidad Moléculas de agua (H2O) tienen una estructura inusual, que los hace similares a un imán: un extremo tiene una carga positiva, mientras que el otro tiene un negativo. Cuando arrojas un compuesto iónico en el agua, estos "imanes" de agua se agruparán a su alrededor, tratando de separar los iones positivos y negativos.[2]
2 Comprender la solubilidad Moléculas de agua (H2O) tienen una estructura inusual, que los hace similares a un imán: un extremo tiene una carga positiva, mientras que el otro tiene un negativo. Cuando arrojas un compuesto iónico en el agua, estos "imanes" de agua se agruparán a su alrededor, tratando de separar los iones positivos y negativos.[2] - Algunos compuestos iónicos no se pegan muy bien; estos son soluble ya que el agua los separará y los disolverá. Otros compuestos están unidos con más fuerza, y son insoluble ya que pueden permanecer juntos a pesar de las moléculas de agua.
- Algunos compuestos tienen enlaces internos que son similares en fuerza a la atracción del agua. Estos se llaman ligeramente soluble, ya que una cantidad significativa de compuestos se separará, pero el resto permanecerá unido.
-
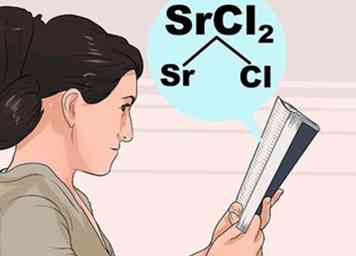 3 Estudia las reglas de solubilidad. Debido a que las interacciones entre los átomos son bastante complejas, no siempre es intuitivo qué compuestos son solubles y cuáles son insolubles. Busque el primer ion en el compuesto en la lista a continuación para descubrir cómo se comporta normalmente, luego verifique las excepciones para asegurarse de que el segundo ion no tenga una interacción inusual.
3 Estudia las reglas de solubilidad. Debido a que las interacciones entre los átomos son bastante complejas, no siempre es intuitivo qué compuestos son solubles y cuáles son insolubles. Busque el primer ion en el compuesto en la lista a continuación para descubrir cómo se comporta normalmente, luego verifique las excepciones para asegurarse de que el segundo ion no tenga una interacción inusual. - Por ejemplo, para verificar el cloruro de estroncio (SrCl2), busque Sr o Cl en los pasos en negrita a continuación. Cl es "generalmente soluble", por lo que verifique si hay excepciones. Sr no figura como una excepción, por lo que SrCl2 debe ser soluble
- Las excepciones más comunes para cada regla se escriben debajo. Hay otras excepciones, pero es poco probable que las encuentre en una clase de química o laboratorio típico.
-
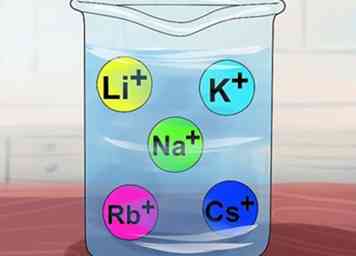 4 Reconozca que los compuestos son solubles si contienen metales alcalinos. Los metales alcalinos incluyen Li+, N / A+, K+, Rb+y Cs+. Estos también se llaman elementos del Grupo IA: litio, sodio, potasio, rubidio y cesio. Casi todos los compuestos que incluyen uno de estos iones son solubles.
4 Reconozca que los compuestos son solubles si contienen metales alcalinos. Los metales alcalinos incluyen Li+, N / A+, K+, Rb+y Cs+. Estos también se llaman elementos del Grupo IA: litio, sodio, potasio, rubidio y cesio. Casi todos los compuestos que incluyen uno de estos iones son solubles. - Excepción: Li3correos4 es insoluble
-
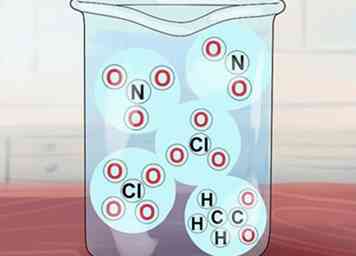 5 Comprenda que algunos otros compuestos son solubles. Estos incluyen compuestos de NO3-, C2H3O2-, NO2-, ClO3-y ClO4-. Respectivamente, estos son los iones de nitrato, acetato, nitrito, clorato y perclorato. Tenga en cuenta que el acetato a menudo se abrevia como OAC.[3]
5 Comprenda que algunos otros compuestos son solubles. Estos incluyen compuestos de NO3-, C2H3O2-, NO2-, ClO3-y ClO4-. Respectivamente, estos son los iones de nitrato, acetato, nitrito, clorato y perclorato. Tenga en cuenta que el acetato a menudo se abrevia como OAC.[3] - Excepciones: Ag (OAc) (acetato de plata) y Hg (OAc)2 (acetato de mercurio) son insolubles.
- AgNO2- y KClO4- son solo "ligeramente solubles".
-
 6 Tenga en cuenta que los compuestos de Cl-, Br-, y yo- son usualmente solubles Los iones de cloruro, bromuro y yoduro casi siempre producen compuestos solubles, llamados sales de halógeno.
6 Tenga en cuenta que los compuestos de Cl-, Br-, y yo- son usualmente solubles Los iones de cloruro, bromuro y yoduro casi siempre producen compuestos solubles, llamados sales de halógeno. - Excepción: Si alguno de estos se empareja con los iones plata Ag+, mercurio Hg22+, o plomo Pb2+, el resultado es insoluble Lo mismo puede decirse de los compuestos menos comunes hechos de maridaje con cobre Cu+ y talio Tl+.
-
 7 Tenga en cuenta que los compuestos que contienen SO42- son usualmente solubles El ion sulfato generalmente forma compuestos solubles, pero hay varias excepciones.
7 Tenga en cuenta que los compuestos que contienen SO42- son usualmente solubles El ion sulfato generalmente forma compuestos solubles, pero hay varias excepciones. - Excepciones: El ion sulfato forma compuestos insolubles con los siguientes iones: Sr de estroncio2+, bario Ba2+, plomo Pb2+, plata Ag+, calcio Ca2+, radio Ra2+y plata diatomea Ag22+. Tenga en cuenta que el sulfato de plata y el sulfato de calcio se disuelven lo suficiente como para que algunas personas lo llamen levemente soluble.
-
 8 Sepa que los compuestos que contienen OH- o S2- son insolubles Estos son los iones hidróxido y sulfuro, respectivamente.
8 Sepa que los compuestos que contienen OH- o S2- son insolubles Estos son los iones hidróxido y sulfuro, respectivamente. - Excepciones: ¿Recuerda los metales alcalinos (Grupo I-A) y cómo les gusta formar compuestos solubles? Li+, N / A+, K+, Rb+y Cs+ todos forman compuestos solubles con hidróxido o iones de sulfuro. Además, el hidróxido forma sales solubles con los iones de la tierra alcalina (Grupo II-A): calcio Ca2+, estroncio Sr2+y barium Ba2+. Tenga en cuenta que los compuestos resultantes de hidróxido y un álcali tierra tienen las moléculas suficientes que permanecen unidas para que a veces se consideren "ligeramente solubles".
-
 9 Comprenda que los compuestos que contienen CO32- o PO43- son insolubles Una última comprobación de iones de carbonato y fosfato, y debe saber qué esperar de su compuesto.
9 Comprenda que los compuestos que contienen CO32- o PO43- son insolubles Una última comprobación de iones de carbonato y fosfato, y debe saber qué esperar de su compuesto. - Excepciones: Estos iones forman compuestos solubles con los sospechosos habituales, los metales alcalinos Li+, N / A+, K+, Rb+y Cs+, así como con amonio NH4+.
Método dos de dos:
Cálculo de la solubilidad del Ksp
-
 1 Busque la constante de solubilidad del producto (Ksp). Esta constante es diferente para cada compuesto, por lo que deberá buscarla en un cuadro en su libro de texto. Debido a que estos valores se determinan experimentalmente, pueden variar ampliamente entre gráficos, por lo que es mejor ir con el gráfico de su libro de texto si tiene uno. A menos que se especifique lo contrario, la mayoría de los cuadros asumen que está trabajando a 25ºC (77ºF).
1 Busque la constante de solubilidad del producto (Ksp). Esta constante es diferente para cada compuesto, por lo que deberá buscarla en un cuadro en su libro de texto. Debido a que estos valores se determinan experimentalmente, pueden variar ampliamente entre gráficos, por lo que es mejor ir con el gráfico de su libro de texto si tiene uno. A menos que se especifique lo contrario, la mayoría de los cuadros asumen que está trabajando a 25ºC (77ºF). - Por ejemplo, si está disolviendo yoduro de plomo, o PbI2, anote la constante de solubilidad del producto.
-
 2 Escribe la ecuación química. Primero, determine cómo el compuesto se divide en iones cuando se disuelve. Luego, escribe una ecuación con el Ksp por un lado y los iones constituyentes por el otro.
2 Escribe la ecuación química. Primero, determine cómo el compuesto se divide en iones cuando se disuelve. Luego, escribe una ecuación con el Ksp por un lado y los iones constituyentes por el otro. - Por ejemplo, una molécula de PbI2 se divide en los iones Pb2+, YO-y un segundo-. (Solo necesita saber o buscar la carga en 1 ion, ya que sabe que el compuesto total siempre tendrá una carga neutra).
- Escribe la ecuación 7.1 × 10-9 = [Pb2+][YO-]2
- La ecuación es la constante de solubilidad del producto, que se puede encontrar para los 2 iones en una tabla de solubilidad. Como hay 2 I- iones, yo- es para el segundo poder.
-
 3 Modificar la ecuación para usar variables. Reescribe la ecuación como un problema de álgebra simple, usando lo que sabes sobre el número de moléculas e iones. Establezca x igual a la cantidad del compuesto que se disolverá y reescriba las variables que representan los números de cada ion en términos de x.
3 Modificar la ecuación para usar variables. Reescribe la ecuación como un problema de álgebra simple, usando lo que sabes sobre el número de moléculas e iones. Establezca x igual a la cantidad del compuesto que se disolverá y reescriba las variables que representan los números de cada ion en términos de x. - En nuestro ejemplo, necesitamos reescribir 7.1 × 10-9 = [Pb2+][YO-]2
- Dado que hay 1 ion de plomo (Pb2+) en el compuesto, el número de moléculas de compuestos disueltos será igual al número de iones de plomo libres. Entonces podemos establecer [Pb2+] a x.
- Dado que hay 2 iones de yodo (I-) para cada ion de plomo, podemos establecer el número de átomos de yodo igual a 2x al cuadrado.
- La ecuación ahora es 7.1 × 10-9 = (x) (2x)2
-
 4 Cuenta para iones comunes, si está presente. Omita este paso si está disolviendo el compuesto en agua pura. Si el compuesto se disuelve en una solución que ya contiene uno o más de los iones constituyentes (un "ion común"), sin embargo, la solubilidad disminuye significativamente.[4] El efecto iónico común es más notable en compuestos que son en su mayoría insolubles, y en estos casos se puede suponer que la gran mayoría de los iones en equilibrio provienen del ion ya presente en la solución. Reescribe la ecuación para incluir la concentración molar conocida (moles por litro, o M) de los iones que ya están en la solución, reemplazando el valor de x que usaste para ese ion.[5]
4 Cuenta para iones comunes, si está presente. Omita este paso si está disolviendo el compuesto en agua pura. Si el compuesto se disuelve en una solución que ya contiene uno o más de los iones constituyentes (un "ion común"), sin embargo, la solubilidad disminuye significativamente.[4] El efecto iónico común es más notable en compuestos que son en su mayoría insolubles, y en estos casos se puede suponer que la gran mayoría de los iones en equilibrio provienen del ion ya presente en la solución. Reescribe la ecuación para incluir la concentración molar conocida (moles por litro, o M) de los iones que ya están en la solución, reemplazando el valor de x que usaste para ese ion.[5] - Por ejemplo, si nuestro compuesto de yoduro de plomo se estaba disolviendo en una solución con 0,2 M de cloruro de plomo (PbCl)2), reescribiríamos nuestra ecuación como 7.1 × 10-9 = (0.2M + x) (2x)2. Entonces, dado que 0.2M es una concentración más alta que x, podemos reescribirla de manera segura como 7.1 × 10-9 = (0.2M) (2x)2.
-
 5 Resuelve la ecuación. Resuelve para x, y sabrás lo soluble que es el compuesto. Debido a cómo se define la constante de solubilidad, su respuesta será en términos de moles del compuesto disuelto, por litro de agua. Es posible que necesite una calculadora para encontrar la respuesta final.
5 Resuelve la ecuación. Resuelve para x, y sabrás lo soluble que es el compuesto. Debido a cómo se define la constante de solubilidad, su respuesta será en términos de moles del compuesto disuelto, por litro de agua. Es posible que necesite una calculadora para encontrar la respuesta final. - Lo siguiente es para la solubilidad en agua pura, no con los iones comunes.
- 7.1×10-9 = (x) (2x)2
- 7.1×10-9 = (x) (4x2)
- 7.1×10-9 = 4x3
- (7.1×10-9) ÷ 4 = x3
- x = ∛ ((7.1 × 10)-9) ÷ 4)
- x = 1.2 x 10-3 moles por litro se disolverán. Esta es una cantidad muy pequeña, por lo que sabe que este compuesto es esencialmente insoluble.
 Minotauromaquia
Minotauromaquia
 1 Aprende sobre los compuestos iónicos. Cada átomo normalmente tiene una cierta cantidad de electrones, pero a veces recogen un electrón extra o pierden uno a través de un proceso conocido como transferencia de electrones.[1] El resultado es un ion, que tiene una carga eléctrica Cuando un ion con una carga negativa (un electrón extra) se encuentra con un ion con una carga positiva (falta un electrón), se unen como los extremos negativo y positivo de 2 imanes. El resultado es un compuesto iónico.
1 Aprende sobre los compuestos iónicos. Cada átomo normalmente tiene una cierta cantidad de electrones, pero a veces recogen un electrón extra o pierden uno a través de un proceso conocido como transferencia de electrones.[1] El resultado es un ion, que tiene una carga eléctrica Cuando un ion con una carga negativa (un electrón extra) se encuentra con un ion con una carga positiva (falta un electrón), se unen como los extremos negativo y positivo de 2 imanes. El resultado es un compuesto iónico.  2 Comprender la solubilidad Moléculas de agua (H2O) tienen una estructura inusual, que los hace similares a un imán: un extremo tiene una carga positiva, mientras que el otro tiene un negativo. Cuando arrojas un compuesto iónico en el agua, estos "imanes" de agua se agruparán a su alrededor, tratando de separar los iones positivos y negativos.[2]
2 Comprender la solubilidad Moléculas de agua (H2O) tienen una estructura inusual, que los hace similares a un imán: un extremo tiene una carga positiva, mientras que el otro tiene un negativo. Cuando arrojas un compuesto iónico en el agua, estos "imanes" de agua se agruparán a su alrededor, tratando de separar los iones positivos y negativos.[2]  3 Estudia las reglas de solubilidad. Debido a que las interacciones entre los átomos son bastante complejas, no siempre es intuitivo qué compuestos son solubles y cuáles son insolubles. Busque el primer ion en el compuesto en la lista a continuación para descubrir cómo se comporta normalmente, luego verifique las excepciones para asegurarse de que el segundo ion no tenga una interacción inusual.
3 Estudia las reglas de solubilidad. Debido a que las interacciones entre los átomos son bastante complejas, no siempre es intuitivo qué compuestos son solubles y cuáles son insolubles. Busque el primer ion en el compuesto en la lista a continuación para descubrir cómo se comporta normalmente, luego verifique las excepciones para asegurarse de que el segundo ion no tenga una interacción inusual.  4 Reconozca que los compuestos son solubles si contienen metales alcalinos. Los metales alcalinos incluyen Li+, N / A+, K+, Rb+y Cs+. Estos también se llaman elementos del Grupo IA: litio, sodio, potasio, rubidio y cesio. Casi todos los compuestos que incluyen uno de estos iones son solubles.
4 Reconozca que los compuestos son solubles si contienen metales alcalinos. Los metales alcalinos incluyen Li+, N / A+, K+, Rb+y Cs+. Estos también se llaman elementos del Grupo IA: litio, sodio, potasio, rubidio y cesio. Casi todos los compuestos que incluyen uno de estos iones son solubles.  5 Comprenda que algunos otros compuestos son solubles. Estos incluyen compuestos de NO3-, C2H3O2-, NO2-, ClO3-y ClO4-. Respectivamente, estos son los iones de nitrato, acetato, nitrito, clorato y perclorato. Tenga en cuenta que el acetato a menudo se abrevia como OAC.[3]
5 Comprenda que algunos otros compuestos son solubles. Estos incluyen compuestos de NO3-, C2H3O2-, NO2-, ClO3-y ClO4-. Respectivamente, estos son los iones de nitrato, acetato, nitrito, clorato y perclorato. Tenga en cuenta que el acetato a menudo se abrevia como OAC.[3]  6 Tenga en cuenta que los compuestos de Cl-, Br-, y yo- son usualmente solubles Los iones de cloruro, bromuro y yoduro casi siempre producen compuestos solubles, llamados sales de halógeno.
6 Tenga en cuenta que los compuestos de Cl-, Br-, y yo- son usualmente solubles Los iones de cloruro, bromuro y yoduro casi siempre producen compuestos solubles, llamados sales de halógeno.  7 Tenga en cuenta que los compuestos que contienen SO42- son usualmente solubles El ion sulfato generalmente forma compuestos solubles, pero hay varias excepciones.
7 Tenga en cuenta que los compuestos que contienen SO42- son usualmente solubles El ion sulfato generalmente forma compuestos solubles, pero hay varias excepciones.  8 Sepa que los compuestos que contienen OH- o S2- son insolubles Estos son los iones hidróxido y sulfuro, respectivamente.
8 Sepa que los compuestos que contienen OH- o S2- son insolubles Estos son los iones hidróxido y sulfuro, respectivamente.  9 Comprenda que los compuestos que contienen CO32- o PO43- son insolubles Una última comprobación de iones de carbonato y fosfato, y debe saber qué esperar de su compuesto.
9 Comprenda que los compuestos que contienen CO32- o PO43- son insolubles Una última comprobación de iones de carbonato y fosfato, y debe saber qué esperar de su compuesto.  1 Busque la constante de solubilidad del producto (Ksp). Esta constante es diferente para cada compuesto, por lo que deberá buscarla en un cuadro en su libro de texto. Debido a que estos valores se determinan experimentalmente, pueden variar ampliamente entre gráficos, por lo que es mejor ir con el gráfico de su libro de texto si tiene uno. A menos que se especifique lo contrario, la mayoría de los cuadros asumen que está trabajando a 25ºC (77ºF).
1 Busque la constante de solubilidad del producto (Ksp). Esta constante es diferente para cada compuesto, por lo que deberá buscarla en un cuadro en su libro de texto. Debido a que estos valores se determinan experimentalmente, pueden variar ampliamente entre gráficos, por lo que es mejor ir con el gráfico de su libro de texto si tiene uno. A menos que se especifique lo contrario, la mayoría de los cuadros asumen que está trabajando a 25ºC (77ºF).  2 Escribe la ecuación química. Primero, determine cómo el compuesto se divide en iones cuando se disuelve. Luego, escribe una ecuación con el Ksp por un lado y los iones constituyentes por el otro.
2 Escribe la ecuación química. Primero, determine cómo el compuesto se divide en iones cuando se disuelve. Luego, escribe una ecuación con el Ksp por un lado y los iones constituyentes por el otro.  3 Modificar la ecuación para usar variables. Reescribe la ecuación como un problema de álgebra simple, usando lo que sabes sobre el número de moléculas e iones. Establezca x igual a la cantidad del compuesto que se disolverá y reescriba las variables que representan los números de cada ion en términos de x.
3 Modificar la ecuación para usar variables. Reescribe la ecuación como un problema de álgebra simple, usando lo que sabes sobre el número de moléculas e iones. Establezca x igual a la cantidad del compuesto que se disolverá y reescriba las variables que representan los números de cada ion en términos de x.  4 Cuenta para iones comunes, si está presente. Omita este paso si está disolviendo el compuesto en agua pura. Si el compuesto se disuelve en una solución que ya contiene uno o más de los iones constituyentes (un "ion común"), sin embargo, la solubilidad disminuye significativamente.[4] El efecto iónico común es más notable en compuestos que son en su mayoría insolubles, y en estos casos se puede suponer que la gran mayoría de los iones en equilibrio provienen del ion ya presente en la solución. Reescribe la ecuación para incluir la concentración molar conocida (moles por litro, o M) de los iones que ya están en la solución, reemplazando el valor de x que usaste para ese ion.[5]
4 Cuenta para iones comunes, si está presente. Omita este paso si está disolviendo el compuesto en agua pura. Si el compuesto se disuelve en una solución que ya contiene uno o más de los iones constituyentes (un "ion común"), sin embargo, la solubilidad disminuye significativamente.[4] El efecto iónico común es más notable en compuestos que son en su mayoría insolubles, y en estos casos se puede suponer que la gran mayoría de los iones en equilibrio provienen del ion ya presente en la solución. Reescribe la ecuación para incluir la concentración molar conocida (moles por litro, o M) de los iones que ya están en la solución, reemplazando el valor de x que usaste para ese ion.[5]  5 Resuelve la ecuación. Resuelve para x, y sabrás lo soluble que es el compuesto. Debido a cómo se define la constante de solubilidad, su respuesta será en términos de moles del compuesto disuelto, por litro de agua. Es posible que necesite una calculadora para encontrar la respuesta final.
5 Resuelve la ecuación. Resuelve para x, y sabrás lo soluble que es el compuesto. Debido a cómo se define la constante de solubilidad, su respuesta será en términos de moles del compuesto disuelto, por litro de agua. Es posible que necesite una calculadora para encontrar la respuesta final.