Una dilución en química es un proceso que reduce la concentración de una sustancia en una solución. Una dilución en serie es la dilución repetida de una solución para amplificar el factor de dilución rápidamente.[1] Se realiza comúnmente en experimentos que requieren soluciones altamente diluidas, como las que involucran curvas de concentración en una escala logarítmica o cuando se determina la densidad de las bacterias. Las diluciones en serie se usan ampliamente en ciencias experimentales como bioquímica, microbiología, farmacología y física.
Método uno de dos:
Realizando una Dilución Básica
-
 1 Determine el líquido de dilución adecuado. El líquido en el que diluirás tu sustancia es muy importante. Muchas soluciones se diluirán en agua destilada, pero este no es siempre el caso. Si está diluyendo bacterias u otras células, es probable que desee diluir en medios de cultivo.[2] El líquido que elija se usará para cada dilución en serie.
1 Determine el líquido de dilución adecuado. El líquido en el que diluirás tu sustancia es muy importante. Muchas soluciones se diluirán en agua destilada, pero este no es siempre el caso. Si está diluyendo bacterias u otras células, es probable que desee diluir en medios de cultivo.[2] El líquido que elija se usará para cada dilución en serie. - Si no está seguro de qué líquido usar, solicite ayuda o consulte en línea para ver si otras personas han realizado una dilución similar.
-
 2 Prepare varios tubos de ensayo con 9 ml de líquido de dilución. Estos tubos servirán como blancos de dilución.[3] Agregará su muestra sin diluir al primer tubo y luego diluirá en serie en los siguientes tubos.
2 Prepare varios tubos de ensayo con 9 ml de líquido de dilución. Estos tubos servirán como blancos de dilución.[3] Agregará su muestra sin diluir al primer tubo y luego diluirá en serie en los siguientes tubos. - Es útil etiquetar todos sus tubos antes de comenzar para que no se confunda una vez que comienza con las diluciones.
- Cada tubo será una dilución de 10 veces a partir del tubo sin diluir.[4] El primer tubo será una dilución 1:10, el segundo un 1: 100, el tercero un 1: 1000, etc. Determine el número de diluciones que necesita hacer de antemano para no desperdiciar los tubos ni diluir el líquido.
-
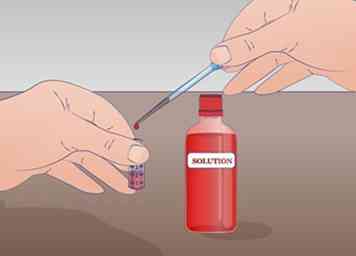 3 Prepare un tubo de ensayo con al menos 2 ml de su solución no diluida. La cantidad mínima necesaria para realizar esta dilución en serie es 1 ml de solución no diluida. Si solo tiene 1 ml, no tendrá ninguna solución restante sin diluir. Etiquetar este tubo NOS para una solución no diluida
3 Prepare un tubo de ensayo con al menos 2 ml de su solución no diluida. La cantidad mínima necesaria para realizar esta dilución en serie es 1 ml de solución no diluida. Si solo tiene 1 ml, no tendrá ninguna solución restante sin diluir. Etiquetar este tubo NOS para una solución no diluida - Mezcle completamente su solución antes de comenzar cualquier dilución.[5]
-
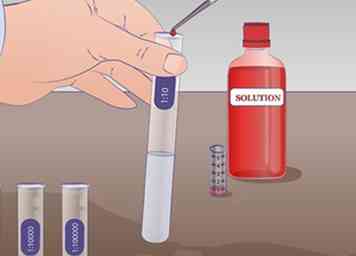 4 Realiza la primera dilución. Dibuja 1 ml de solución no diluida del tubo de ensayo NOS con una pipeta y transferirlo al tubo de ensayo etiquetado 1:10 que contiene 9 ml del líquido de dilución y mezcle bien. Ahora hay 1 ml de la solución no diluida en 9 ml del líquido de dilución. La solución, por lo tanto, se ha diluido por un factor de 10.
4 Realiza la primera dilución. Dibuja 1 ml de solución no diluida del tubo de ensayo NOS con una pipeta y transferirlo al tubo de ensayo etiquetado 1:10 que contiene 9 ml del líquido de dilución y mezcle bien. Ahora hay 1 ml de la solución no diluida en 9 ml del líquido de dilución. La solución, por lo tanto, se ha diluido por un factor de 10. -
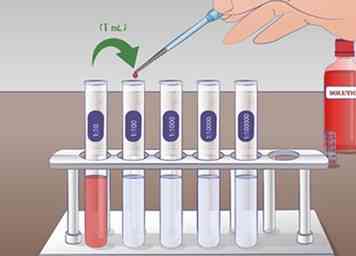 5 Realiza la segunda dilución. Para la segunda dilución en serie, tomará 1 ml de solución del tubo 1:10 y agréguela a los 9 ml de líquido de dilución en el tubo 1:100. Mezcle bien el tubo 1:10 antes de agregar al siguiente tubo. Nuevamente, mezcla el tubo 1:100 siguiente dilución La solución del tubo de ensayo 1:10 ha sido diluido 10 veces en tubo de ensayo 1:100.
5 Realiza la segunda dilución. Para la segunda dilución en serie, tomará 1 ml de solución del tubo 1:10 y agréguela a los 9 ml de líquido de dilución en el tubo 1:100. Mezcle bien el tubo 1:10 antes de agregar al siguiente tubo. Nuevamente, mezcla el tubo 1:100 siguiente dilución La solución del tubo de ensayo 1:10 ha sido diluido 10 veces en tubo de ensayo 1:100. -
 6 Extienda este procedimiento para realizar diluciones en serie más largas. Este proceso puede repetirse tantas veces como sea necesario para lograr la solución deseada. En un experimento que involucra curvas de concentración, puede usar una dilución en serie para crear una serie de soluciones con diluciones de 1, 1:10, 1: 100, 1: 1,000.
6 Extienda este procedimiento para realizar diluciones en serie más largas. Este proceso puede repetirse tantas veces como sea necesario para lograr la solución deseada. En un experimento que involucra curvas de concentración, puede usar una dilución en serie para crear una serie de soluciones con diluciones de 1, 1:10, 1: 100, 1: 1,000.
Método dos de dos:
Cálculo del factor de dilución final y la concentración
-
 1 Calcule la relación de dilución final en una dilución en serie. La relación de dilución total se puede determinar multiplicando el factor de dilución de cada paso que conduce al paso final. Esto se puede ilustrar matemáticamente con la ecuación ret = D1 x D2 x D3 x ... x Dnorte dónde ret es el factor de dilución total y renorte es la relación de dilución.[6]
1 Calcule la relación de dilución final en una dilución en serie. La relación de dilución total se puede determinar multiplicando el factor de dilución de cada paso que conduce al paso final. Esto se puede ilustrar matemáticamente con la ecuación ret = D1 x D2 x D3 x ... x Dnorte dónde ret es el factor de dilución total y renorte es la relación de dilución.[6] - Por ejemplo, supongamos que hiciste una dilución 1:10 de tu líquido 4 veces. Conecta tu factor de dilución en la ecuación: Dt = 10 x 10 x 10 x 10 = 10,000
- El factor de dilución final del cuarto tubo en su dilución serial es 1: 10,000. La concentración de su sustancia es ahora 10.000 veces menor que la solución original sin diluir.
-
 2 Determine la concentración de la solución después de la dilución. Para determinar la concentración final de su solución luego de la dilución serial, necesitará conocer su concentración inicial. La ecuación es dofinal = Cinicial/RE dónde dofinal es la concentración final de la solución diluida, doinicial es la concentración inicial de la solución original y re es la relación de dilución previamente determinada.[7]
2 Determine la concentración de la solución después de la dilución. Para determinar la concentración final de su solución luego de la dilución serial, necesitará conocer su concentración inicial. La ecuación es dofinal = Cinicial/RE dónde dofinal es la concentración final de la solución diluida, doinicial es la concentración inicial de la solución original y re es la relación de dilución previamente determinada.[7] - Por ejemplo: si comenzó con una solución de células con una concentración de 1,000,000 de células por ml y su proporción de dilución es 1,000, ¿cuál es la concentración final de su muestra diluida?
- Usando la ecuación:
- dofinal = Cinicial/RE
- dofinal = 1,000,000/1,000
- dofinal = 1,000 células por mL.
-
 3 Confirme que todas las unidades coinciden. Al realizar cualquier cálculo, quiere asegurarse de que sus unidades siempre coincidan al final.[8] Si comenzó con células por ml, asegúrese de terminar con células por ml. Si su concentración inicial es partes por millón (ppm), entonces su concentración final debe ser ppm.
3 Confirme que todas las unidades coinciden. Al realizar cualquier cálculo, quiere asegurarse de que sus unidades siempre coincidan al final.[8] Si comenzó con células por ml, asegúrese de terminar con células por ml. Si su concentración inicial es partes por millón (ppm), entonces su concentración final debe ser ppm.
 Minotauromaquia
Minotauromaquia
 1 Determine el líquido de dilución adecuado. El líquido en el que diluirás tu sustancia es muy importante. Muchas soluciones se diluirán en agua destilada, pero este no es siempre el caso. Si está diluyendo bacterias u otras células, es probable que desee diluir en medios de cultivo.[2] El líquido que elija se usará para cada dilución en serie.
1 Determine el líquido de dilución adecuado. El líquido en el que diluirás tu sustancia es muy importante. Muchas soluciones se diluirán en agua destilada, pero este no es siempre el caso. Si está diluyendo bacterias u otras células, es probable que desee diluir en medios de cultivo.[2] El líquido que elija se usará para cada dilución en serie.  2 Prepare varios tubos de ensayo con 9 ml de líquido de dilución. Estos tubos servirán como blancos de dilución.[3] Agregará su muestra sin diluir al primer tubo y luego diluirá en serie en los siguientes tubos.
2 Prepare varios tubos de ensayo con 9 ml de líquido de dilución. Estos tubos servirán como blancos de dilución.[3] Agregará su muestra sin diluir al primer tubo y luego diluirá en serie en los siguientes tubos.  3 Prepare un tubo de ensayo con al menos 2 ml de su solución no diluida. La cantidad mínima necesaria para realizar esta dilución en serie es 1 ml de solución no diluida. Si solo tiene 1 ml, no tendrá ninguna solución restante sin diluir. Etiquetar este tubo NOS para una solución no diluida
3 Prepare un tubo de ensayo con al menos 2 ml de su solución no diluida. La cantidad mínima necesaria para realizar esta dilución en serie es 1 ml de solución no diluida. Si solo tiene 1 ml, no tendrá ninguna solución restante sin diluir. Etiquetar este tubo NOS para una solución no diluida  4 Realiza la primera dilución. Dibuja 1 ml de solución no diluida del tubo de ensayo NOS con una pipeta y transferirlo al tubo de ensayo etiquetado 1:10 que contiene 9 ml del líquido de dilución y mezcle bien. Ahora hay 1 ml de la solución no diluida en 9 ml del líquido de dilución. La solución, por lo tanto, se ha diluido por un factor de 10.
4 Realiza la primera dilución. Dibuja 1 ml de solución no diluida del tubo de ensayo NOS con una pipeta y transferirlo al tubo de ensayo etiquetado 1:10 que contiene 9 ml del líquido de dilución y mezcle bien. Ahora hay 1 ml de la solución no diluida en 9 ml del líquido de dilución. La solución, por lo tanto, se ha diluido por un factor de 10.  5 Realiza la segunda dilución. Para la segunda dilución en serie, tomará 1 ml de solución del tubo 1:10 y agréguela a los 9 ml de líquido de dilución en el tubo 1:100. Mezcle bien el tubo 1:10 antes de agregar al siguiente tubo. Nuevamente, mezcla el tubo 1:100 siguiente dilución La solución del tubo de ensayo 1:10 ha sido diluido 10 veces en tubo de ensayo 1:100.
5 Realiza la segunda dilución. Para la segunda dilución en serie, tomará 1 ml de solución del tubo 1:10 y agréguela a los 9 ml de líquido de dilución en el tubo 1:100. Mezcle bien el tubo 1:10 antes de agregar al siguiente tubo. Nuevamente, mezcla el tubo 1:100 siguiente dilución La solución del tubo de ensayo 1:10 ha sido diluido 10 veces en tubo de ensayo 1:100.  6 Extienda este procedimiento para realizar diluciones en serie más largas. Este proceso puede repetirse tantas veces como sea necesario para lograr la solución deseada. En un experimento que involucra curvas de concentración, puede usar una dilución en serie para crear una serie de soluciones con diluciones de 1, 1:10, 1: 100, 1: 1,000.
6 Extienda este procedimiento para realizar diluciones en serie más largas. Este proceso puede repetirse tantas veces como sea necesario para lograr la solución deseada. En un experimento que involucra curvas de concentración, puede usar una dilución en serie para crear una serie de soluciones con diluciones de 1, 1:10, 1: 100, 1: 1,000.  1 Calcule la relación de dilución final en una dilución en serie. La relación de dilución total se puede determinar multiplicando el factor de dilución de cada paso que conduce al paso final. Esto se puede ilustrar matemáticamente con la ecuación ret = D1 x D2 x D3 x ... x Dnorte dónde ret es el factor de dilución total y renorte es la relación de dilución.[6]
1 Calcule la relación de dilución final en una dilución en serie. La relación de dilución total se puede determinar multiplicando el factor de dilución de cada paso que conduce al paso final. Esto se puede ilustrar matemáticamente con la ecuación ret = D1 x D2 x D3 x ... x Dnorte dónde ret es el factor de dilución total y renorte es la relación de dilución.[6]  2 Determine la concentración de la solución después de la dilución. Para determinar la concentración final de su solución luego de la dilución serial, necesitará conocer su concentración inicial. La ecuación es dofinal = Cinicial/RE dónde dofinal es la concentración final de la solución diluida, doinicial es la concentración inicial de la solución original y re es la relación de dilución previamente determinada.[7]
2 Determine la concentración de la solución después de la dilución. Para determinar la concentración final de su solución luego de la dilución serial, necesitará conocer su concentración inicial. La ecuación es dofinal = Cinicial/RE dónde dofinal es la concentración final de la solución diluida, doinicial es la concentración inicial de la solución original y re es la relación de dilución previamente determinada.[7]  3 Confirme que todas las unidades coinciden. Al realizar cualquier cálculo, quiere asegurarse de que sus unidades siempre coincidan al final.[8] Si comenzó con células por ml, asegúrese de terminar con células por ml. Si su concentración inicial es partes por millón (ppm), entonces su concentración final debe ser ppm.
3 Confirme que todas las unidades coinciden. Al realizar cualquier cálculo, quiere asegurarse de que sus unidades siempre coincidan al final.[8] Si comenzó con células por ml, asegúrese de terminar con células por ml. Si su concentración inicial es partes por millón (ppm), entonces su concentración final debe ser ppm.