La fórmula empírica de un compuesto es la expresión escrita más simple de su composición elemental. Debería poder determinar la fórmula empírica de cualquier compuesto siempre que conozca la masa de cada elemento presente, el porcentaje de masa de cada elemento presente o la fórmula molecular del compuesto.
Método uno de tres:
Método uno: usar porcentajes de peso [1]
-
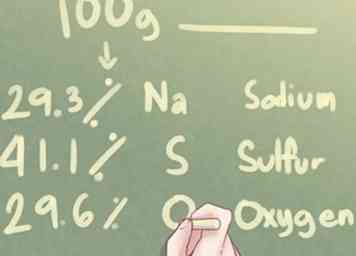 1 Mira los datos. Si le dan la composición elemental de un compuesto desconocido en porcentajes en lugar de gramos, debe suponer que hay exactamente 100 gramos de la sustancia involucrada.
1 Mira los datos. Si le dan la composición elemental de un compuesto desconocido en porcentajes en lugar de gramos, debe suponer que hay exactamente 100 gramos de la sustancia involucrada. - Estas son las instrucciones que debe seguir si lo anterior es cierto. Si le dan la composición elemental de una sustancia desconocida en gramos, consulte la sección sobre "Uso de peso en gramos".
- Ejemplo: Determine la fórmula empírica de un compuesto hecho de 29.3% de Na (sodio), 41.1% de S (azufre) y 29.6% de O (oxígeno).
-
 2 Determine la cantidad de gramos para cada elemento. En base a la suposición de que hay 100 gramos de la sustancia desconocida, puede determinar que la cantidad de gramos presentes para cada elemento es igual al valor porcentual de cada elemento mencionado en el problema.
2 Determine la cantidad de gramos para cada elemento. En base a la suposición de que hay 100 gramos de la sustancia desconocida, puede determinar que la cantidad de gramos presentes para cada elemento es igual al valor porcentual de cada elemento mencionado en el problema. - Ejemplo: Para 100 g de sustancia desconocida, hay 29.3 g de Na, 41.1 g de S y 29.6 g de O.
-
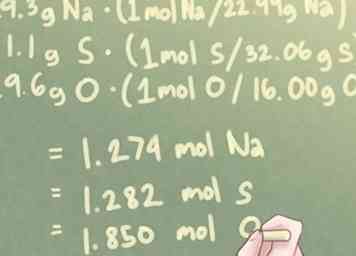 3 Convierte la masa de cada elemento en moles. La masa de cada elemento en su composición, expresada actualmente en gramos, tendrá que convertirse en moles. Para hacerlo, cada masa debe multiplicarse por la relación molar por sus respectivos pesos atómicos.
3 Convierte la masa de cada elemento en moles. La masa de cada elemento en su composición, expresada actualmente en gramos, tendrá que convertirse en moles. Para hacerlo, cada masa debe multiplicarse por la relación molar por sus respectivos pesos atómicos. - En términos más simples, tendrá que dividir cada masa por el peso atómico de ese elemento.
- También tenga en cuenta que los pesos atómicos utilizados en este cálculo deben incluir al menos cuatro cifras significativas.
- Ejemplo: Para un compuesto con 29.3 g de Na, 41.1 g de S y 29.6 g de O:
- 29.3 g Na * (1 mol S / 22.99 g Na) = 1.274 mol Na
- 41.1 g S * (1 mol S / 32.06 g S) = 1.282 mol S
- 29.6 g O * (1 mol O / 16.00 g O) = 1.850 mol O
-
 4 Divida cada valor molar por el menor número de moles presente. Necesitarás un estequiométrico comparación entre los elementos de su compuesto, lo que significa esencialmente que necesita calcular la cantidad de un elemento que tiene en relación con los otros elementos presentes en su compuesto. Para hacer esto, divida cada número de moles por el menor número de moles presente.
4 Divida cada valor molar por el menor número de moles presente. Necesitarás un estequiométrico comparación entre los elementos de su compuesto, lo que significa esencialmente que necesita calcular la cantidad de un elemento que tiene en relación con los otros elementos presentes en su compuesto. Para hacer esto, divida cada número de moles por el menor número de moles presente. - Ejemplo: El número más pequeño de moles presentes en el compuesto es 1.274 moles (el número de moles para Na, sodio).
- 1.274 mol Na / 1.274 mol = 1.000 Na
- 1.282 mol S / 1.274 mol = 1.006 S
- 1.850 mol O / 1.274 mol = 1.452 O
- Ejemplo: El número más pequeño de moles presentes en el compuesto es 1.274 moles (el número de moles para Na, sodio).
-
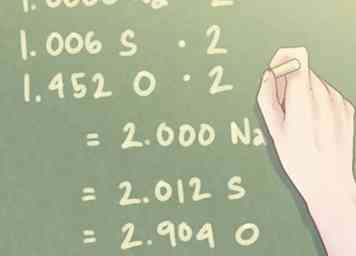 5 Multiplica los valores de proporción para encontrar números enteros. La cantidad de moles presentes para cada elemento puede no ser igual a los números enteros. Para valores pequeños que están dentro de un décimo valor de distancia de un número entero, esto no presenta ningún problema. Sin embargo, una vez que tenga un exceso de valor que exceda esta cantidad, debe multiplicar los valores de razón según sea necesario para elevar ese valor a un número entero.
5 Multiplica los valores de proporción para encontrar números enteros. La cantidad de moles presentes para cada elemento puede no ser igual a los números enteros. Para valores pequeños que están dentro de un décimo valor de distancia de un número entero, esto no presenta ningún problema. Sin embargo, una vez que tenga un exceso de valor que exceda esta cantidad, debe multiplicar los valores de razón según sea necesario para elevar ese valor a un número entero. - Si un elemento tiene un valor cercano a 0.5, multiplica cada elemento por 2. De forma similar, si un elemento tiene un valor cercano a 0.25, multiplica cada elemento por 4.
- Ejemplo: Como la cantidad de oxígeno (O) presente es cercana a 1.5, necesitará multiplicar cada valor por "2" para acercar la proporción de oxígeno a un número entero.
- 1.000 Na * 2 = 2.000 Na
- 1.006 S * 2 = 2.012 S
- 1.452 O * 2 = 2.904 O
-
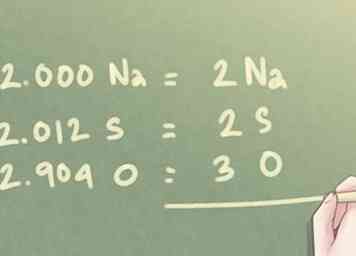 6 Redondee los valores a los números enteros más cercanos. Incluso después del último paso, la cantidad de moles presente para cada elemento puede no estar en números enteros exactos. Como no se utilizan decimales en las fórmulas empíricas, deberá redondear cada valor al número entero más cercano.
6 Redondee los valores a los números enteros más cercanos. Incluso después del último paso, la cantidad de moles presente para cada elemento puede no estar en números enteros exactos. Como no se utilizan decimales en las fórmulas empíricas, deberá redondear cada valor al número entero más cercano. - Ejemplo: Para la relación determinada en el paso anterior:
- 2.000 Na puede escribirse como 2 Na.
- 2.012 S se puede redondear a 2 S.
- 2.904 O se puede redondear hasta 3 O.
- Ejemplo: Para la relación determinada en el paso anterior:
-
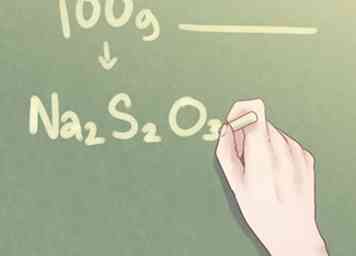 7 Escribe tu respuesta final. Traduzca la proporción de elementos en el formato estándar utilizado para la fórmula empírica. La cantidad molecular de cada elemento debe indicarse en el subíndice junto al símbolo de su elemento respectivo para todas las cantidades mayores que uno.
7 Escribe tu respuesta final. Traduzca la proporción de elementos en el formato estándar utilizado para la fórmula empírica. La cantidad molecular de cada elemento debe indicarse en el subíndice junto al símbolo de su elemento respectivo para todas las cantidades mayores que uno. - Ejemplo: Para un compuesto que es 2 partes de Na, 2 partes de S y 3 partes de O, la fórmula empírica debe escribirse como: Na2S2O3
Método dos de tres:
Método dos: uso de peso en gramos
-
 1 Considera la cantidad de gramos. Si le dan la composición elemental de una sustancia desconocida en gramos, deberá proceder de acuerdo con las siguientes instrucciones.
1 Considera la cantidad de gramos. Si le dan la composición elemental de una sustancia desconocida en gramos, deberá proceder de acuerdo con las siguientes instrucciones. - Por otro lado, si le dan la composición en porcentajes en lugar de gramos, consulte las instrucciones en "Uso de porcentajes de peso".
- Ejemplo: Determine la fórmula empírica de una sustancia desconocida hecha a partir de 8.5 g de Fe (hierro) y 3.8 g de O (oxígeno).
-
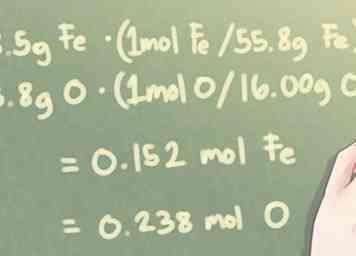 2 Convierte la masa de cada elemento en moles. Para determinar la relación molecular de los elementos en el compuesto, debe convertir la cantidad de cada elemento de gramos a moles. Hazlo dividiendo la masa en gramos para cada elemento por los respectivos pesos atómicos de los elementos.
2 Convierte la masa de cada elemento en moles. Para determinar la relación molecular de los elementos en el compuesto, debe convertir la cantidad de cada elemento de gramos a moles. Hazlo dividiendo la masa en gramos para cada elemento por los respectivos pesos atómicos de los elementos. - Desde una perspectiva más técnica, en realidad está multiplicando la masa en gramos por la relación molar por peso atómico.
- Tenga en cuenta que el peso atómico debe redondearse a cuatro lugares significativos para mantener un cierto grado de precisión en sus cálculos.
- Ejemplo: Cuando hay 8.5 g de Fe y 3.8 g de O:
- 8.5 g Fe * (1 mol Fe / 55.85 g Fe) = 0.152 mol Fe
- 3.8 g O * (1 mol O / 16.00 g O) = 0.238 mol O
-
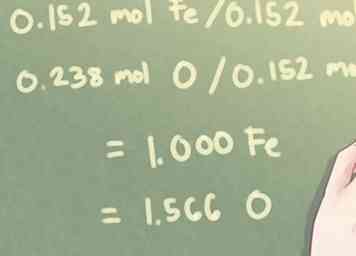 3 Divida cada valor molar por el número calculado más pequeño. Determine cuánto de cada elemento está presente cuando está comparado con los otros elementos en el compuesto.Para calcular esto, necesitarás identificar la cantidad más pequeña de moles presente y dividir cada número de moles por ese número.
3 Divida cada valor molar por el número calculado más pequeño. Determine cuánto de cada elemento está presente cuando está comparado con los otros elementos en el compuesto.Para calcular esto, necesitarás identificar la cantidad más pequeña de moles presente y dividir cada número de moles por ese número. - Ejemplo: Para este problema, la cantidad más pequeña de moles presente es de 0.152 moles (la cantidad de Fe, hierro, presente).
- 0.152 mol Fe / 0.152 mol = 1.000 Fe
- 0.238 mol O / 0.152 mol = 1.566 O
- Ejemplo: Para este problema, la cantidad más pequeña de moles presente es de 0.152 moles (la cantidad de Fe, hierro, presente).
-
 4 Multiplica los valores de proporción para encontrar números enteros. A menudo, los moles presentes para cada sustancia pueden no ser iguales a un número entero. Si el exceso está dentro de una décima parte, simplemente puede redondearlo. Sin embargo, para los valores excedentes que superan esto, deberá multiplicar cada valor por un número que pueda acercar el valor de la razón a un número entero.
4 Multiplica los valores de proporción para encontrar números enteros. A menudo, los moles presentes para cada sustancia pueden no ser iguales a un número entero. Si el exceso está dentro de una décima parte, simplemente puede redondearlo. Sin embargo, para los valores excedentes que superan esto, deberá multiplicar cada valor por un número que pueda acercar el valor de la razón a un número entero. - Por ejemplo, si un elemento tiene un exceso cercano a 0.25, multiplique la cantidad de cada elemento por 4. Si un elemento tiene un exceso cercano a 0.5, multiplique la cantidad de cada elemento por 2.
- Ejemplo: Dado que la proporción de oxígeno es igual a 1.566, deberá multiplicar ambas proporciones de razón por 2.
- 1.000 Fe * 2 = 2.000 Fe
- 1.566 O * 2 = 3.132 O
-
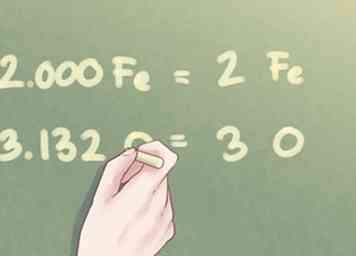 5 Redondea tu respuesta al número entero más cercano. Una vez que los valores de razón de todos los elementos en el compuesto están aproximadamente dentro de una décima parte de un número entero, puede redondear cualquier diferencia al número entero más cercano.
5 Redondea tu respuesta al número entero más cercano. Una vez que los valores de razón de todos los elementos en el compuesto están aproximadamente dentro de una décima parte de un número entero, puede redondear cualquier diferencia al número entero más cercano. - Ejemplo: La cantidad de Fe se puede escribir como 2. La cantidad de O se puede redondear a 3.
-
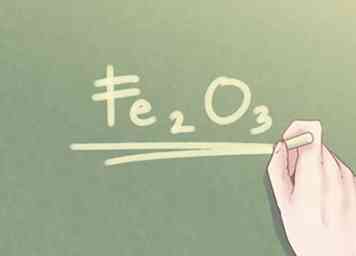 6 Escribe la respuesta final. La proporción de elementos debe reescribirse en forma de fórmula empírica. Cada valor de relación debe indicarse en subíndice junto al símbolo de su elemento respectivo, a menos que el valor de razón sea igual a uno.
6 Escribe la respuesta final. La proporción de elementos debe reescribirse en forma de fórmula empírica. Cada valor de relación debe indicarse en subíndice junto al símbolo de su elemento respectivo, a menos que el valor de razón sea igual a uno. - Ejemplo: Para un compuesto que es 2 partes de Fe y 3 partes de O, la fórmula empírica es: Fe2O3
Método tres de tres:
Método tres: uso de fórmula molecular [2]
-
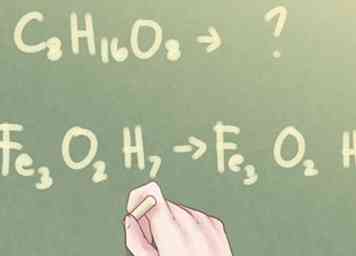 1 Determine si los subscripts se pueden reducir. Si tiene la fórmula molecular de un compuesto desconocido pero le dicen que identifique el compuesto por su fórmula empírica, debe determinar si la fórmula se puede reducir. Mira los subíndices para cada elemento presente. Si los tres subíndices comparten al menos un factor común (que no sea el número 1), deberá realizar algunos pasos más para determinar la fórmula empírica del compuesto.
1 Determine si los subscripts se pueden reducir. Si tiene la fórmula molecular de un compuesto desconocido pero le dicen que identifique el compuesto por su fórmula empírica, debe determinar si la fórmula se puede reducir. Mira los subíndices para cada elemento presente. Si los tres subíndices comparten al menos un factor común (que no sea el número 1), deberá realizar algunos pasos más para determinar la fórmula empírica del compuesto. - Ejemplo: do8H16O8
- Por otro lado, si los subíndices no comparten un factor común, la fórmula molecular es también la fórmula empírica.
- Ejemplo: Fe3O2H7
-
 2 Encuentra el mayor factor común entre los subíndices. Escriba los factores de cada subíndice dentro de su fórmula. Identifique qué factor tiene el mayor valor.
2 Encuentra el mayor factor común entre los subíndices. Escriba los factores de cada subíndice dentro de su fórmula. Identifique qué factor tiene el mayor valor. - Ejemplo: Para C8H16O8, los subíndices son "16" y "8"
- Los factores de 8 son: 1, 2, 4, 8
- Los factores de 16 son: 1, 2, 4, 8, 16
- El mayor factor común (MCD) entre los dos números es 8.
- Ejemplo: Para C8H16O8, los subíndices son "16" y "8"
-
 3 Divida cada subíndice por el mayor factor común. Para obtener cada subíndice en su forma más simple, deberá dividir todos los subíndices presentes en la fórmula por el GCF que acaba de encontrar.
3 Divida cada subíndice por el mayor factor común. Para obtener cada subíndice en su forma más simple, deberá dividir todos los subíndices presentes en la fórmula por el GCF que acaba de encontrar. - Ejemplo: Para C8H16O8:
- Divida el subíndice de 8 por el MCD de 8: 8/8 = 1
- Divida el subíndice de 16 por el MCD de 8: 16/8 = 2
- Ejemplo: Para C8H16O8:
-
 4 Escribe la respuesta final. Reemplace sus subíndices originales con sus valores simplificados. Al hacerlo, ha determinado la fórmula empírica del compuesto a partir de su fórmula molecular.
4 Escribe la respuesta final. Reemplace sus subíndices originales con sus valores simplificados. Al hacerlo, ha determinado la fórmula empírica del compuesto a partir de su fórmula molecular. - Tenga en cuenta que los valores de 1 generalmente no se indican con subíndices.
- Ejemplo: do8H16O8 = CH2O
 Minotauromaquia
Minotauromaquia
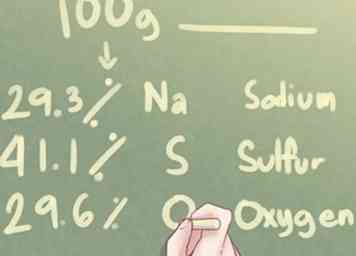 1 Mira los datos. Si le dan la composición elemental de un compuesto desconocido en porcentajes en lugar de gramos, debe suponer que hay exactamente 100 gramos de la sustancia involucrada.
1 Mira los datos. Si le dan la composición elemental de un compuesto desconocido en porcentajes en lugar de gramos, debe suponer que hay exactamente 100 gramos de la sustancia involucrada.  2 Determine la cantidad de gramos para cada elemento. En base a la suposición de que hay 100 gramos de la sustancia desconocida, puede determinar que la cantidad de gramos presentes para cada elemento es igual al valor porcentual de cada elemento mencionado en el problema.
2 Determine la cantidad de gramos para cada elemento. En base a la suposición de que hay 100 gramos de la sustancia desconocida, puede determinar que la cantidad de gramos presentes para cada elemento es igual al valor porcentual de cada elemento mencionado en el problema. 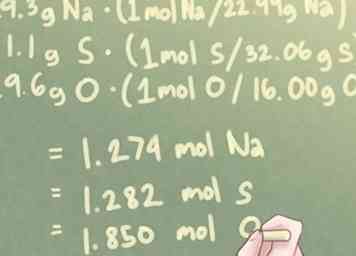 3 Convierte la masa de cada elemento en moles. La masa de cada elemento en su composición, expresada actualmente en gramos, tendrá que convertirse en moles. Para hacerlo, cada masa debe multiplicarse por la relación molar por sus respectivos pesos atómicos.
3 Convierte la masa de cada elemento en moles. La masa de cada elemento en su composición, expresada actualmente en gramos, tendrá que convertirse en moles. Para hacerlo, cada masa debe multiplicarse por la relación molar por sus respectivos pesos atómicos.  4 Divida cada valor molar por el menor número de moles presente. Necesitarás un estequiométrico comparación entre los elementos de su compuesto, lo que significa esencialmente que necesita calcular la cantidad de un elemento que tiene en relación con los otros elementos presentes en su compuesto. Para hacer esto, divida cada número de moles por el menor número de moles presente.
4 Divida cada valor molar por el menor número de moles presente. Necesitarás un estequiométrico comparación entre los elementos de su compuesto, lo que significa esencialmente que necesita calcular la cantidad de un elemento que tiene en relación con los otros elementos presentes en su compuesto. Para hacer esto, divida cada número de moles por el menor número de moles presente. 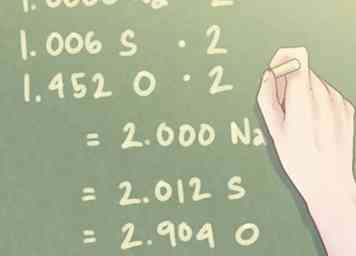 5 Multiplica los valores de proporción para encontrar números enteros. La cantidad de moles presentes para cada elemento puede no ser igual a los números enteros. Para valores pequeños que están dentro de un décimo valor de distancia de un número entero, esto no presenta ningún problema. Sin embargo, una vez que tenga un exceso de valor que exceda esta cantidad, debe multiplicar los valores de razón según sea necesario para elevar ese valor a un número entero.
5 Multiplica los valores de proporción para encontrar números enteros. La cantidad de moles presentes para cada elemento puede no ser igual a los números enteros. Para valores pequeños que están dentro de un décimo valor de distancia de un número entero, esto no presenta ningún problema. Sin embargo, una vez que tenga un exceso de valor que exceda esta cantidad, debe multiplicar los valores de razón según sea necesario para elevar ese valor a un número entero. 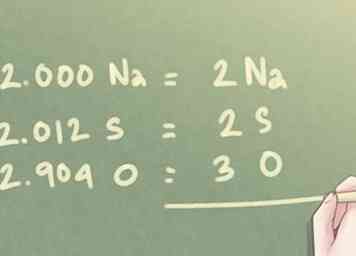 6 Redondee los valores a los números enteros más cercanos. Incluso después del último paso, la cantidad de moles presente para cada elemento puede no estar en números enteros exactos. Como no se utilizan decimales en las fórmulas empíricas, deberá redondear cada valor al número entero más cercano.
6 Redondee los valores a los números enteros más cercanos. Incluso después del último paso, la cantidad de moles presente para cada elemento puede no estar en números enteros exactos. Como no se utilizan decimales en las fórmulas empíricas, deberá redondear cada valor al número entero más cercano. 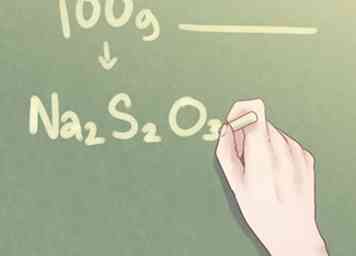 7 Escribe tu respuesta final. Traduzca la proporción de elementos en el formato estándar utilizado para la fórmula empírica. La cantidad molecular de cada elemento debe indicarse en el subíndice junto al símbolo de su elemento respectivo para todas las cantidades mayores que uno.
7 Escribe tu respuesta final. Traduzca la proporción de elementos en el formato estándar utilizado para la fórmula empírica. La cantidad molecular de cada elemento debe indicarse en el subíndice junto al símbolo de su elemento respectivo para todas las cantidades mayores que uno.  1 Considera la cantidad de gramos. Si le dan la composición elemental de una sustancia desconocida en gramos, deberá proceder de acuerdo con las siguientes instrucciones.
1 Considera la cantidad de gramos. Si le dan la composición elemental de una sustancia desconocida en gramos, deberá proceder de acuerdo con las siguientes instrucciones. 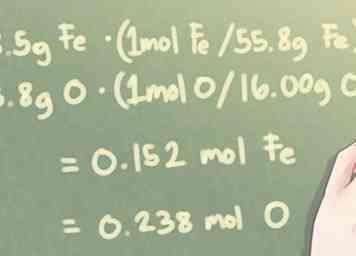 2 Convierte la masa de cada elemento en moles. Para determinar la relación molecular de los elementos en el compuesto, debe convertir la cantidad de cada elemento de gramos a moles. Hazlo dividiendo la masa en gramos para cada elemento por los respectivos pesos atómicos de los elementos.
2 Convierte la masa de cada elemento en moles. Para determinar la relación molecular de los elementos en el compuesto, debe convertir la cantidad de cada elemento de gramos a moles. Hazlo dividiendo la masa en gramos para cada elemento por los respectivos pesos atómicos de los elementos. 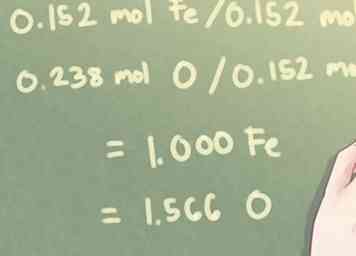 3 Divida cada valor molar por el número calculado más pequeño. Determine cuánto de cada elemento está presente cuando está comparado con los otros elementos en el compuesto.Para calcular esto, necesitarás identificar la cantidad más pequeña de moles presente y dividir cada número de moles por ese número.
3 Divida cada valor molar por el número calculado más pequeño. Determine cuánto de cada elemento está presente cuando está comparado con los otros elementos en el compuesto.Para calcular esto, necesitarás identificar la cantidad más pequeña de moles presente y dividir cada número de moles por ese número.  4 Multiplica los valores de proporción para encontrar números enteros. A menudo, los moles presentes para cada sustancia pueden no ser iguales a un número entero. Si el exceso está dentro de una décima parte, simplemente puede redondearlo. Sin embargo, para los valores excedentes que superan esto, deberá multiplicar cada valor por un número que pueda acercar el valor de la razón a un número entero.
4 Multiplica los valores de proporción para encontrar números enteros. A menudo, los moles presentes para cada sustancia pueden no ser iguales a un número entero. Si el exceso está dentro de una décima parte, simplemente puede redondearlo. Sin embargo, para los valores excedentes que superan esto, deberá multiplicar cada valor por un número que pueda acercar el valor de la razón a un número entero. 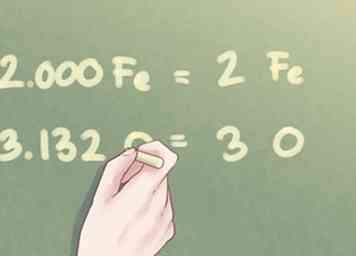 5 Redondea tu respuesta al número entero más cercano. Una vez que los valores de razón de todos los elementos en el compuesto están aproximadamente dentro de una décima parte de un número entero, puede redondear cualquier diferencia al número entero más cercano.
5 Redondea tu respuesta al número entero más cercano. Una vez que los valores de razón de todos los elementos en el compuesto están aproximadamente dentro de una décima parte de un número entero, puede redondear cualquier diferencia al número entero más cercano. 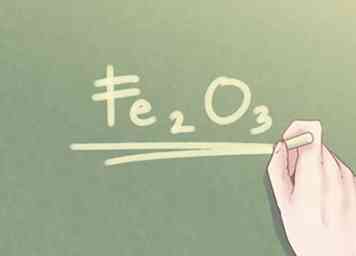 6 Escribe la respuesta final. La proporción de elementos debe reescribirse en forma de fórmula empírica. Cada valor de relación debe indicarse en subíndice junto al símbolo de su elemento respectivo, a menos que el valor de razón sea igual a uno.
6 Escribe la respuesta final. La proporción de elementos debe reescribirse en forma de fórmula empírica. Cada valor de relación debe indicarse en subíndice junto al símbolo de su elemento respectivo, a menos que el valor de razón sea igual a uno. 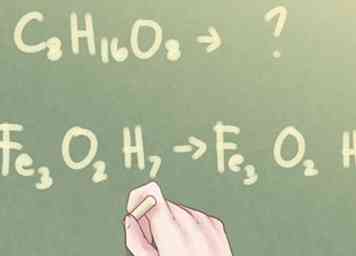 1 Determine si los subscripts se pueden reducir. Si tiene la fórmula molecular de un compuesto desconocido pero le dicen que identifique el compuesto por su fórmula empírica, debe determinar si la fórmula se puede reducir. Mira los subíndices para cada elemento presente. Si los tres subíndices comparten al menos un factor común (que no sea el número 1), deberá realizar algunos pasos más para determinar la fórmula empírica del compuesto.
1 Determine si los subscripts se pueden reducir. Si tiene la fórmula molecular de un compuesto desconocido pero le dicen que identifique el compuesto por su fórmula empírica, debe determinar si la fórmula se puede reducir. Mira los subíndices para cada elemento presente. Si los tres subíndices comparten al menos un factor común (que no sea el número 1), deberá realizar algunos pasos más para determinar la fórmula empírica del compuesto.  2 Encuentra el mayor factor común entre los subíndices. Escriba los factores de cada subíndice dentro de su fórmula. Identifique qué factor tiene el mayor valor.
2 Encuentra el mayor factor común entre los subíndices. Escriba los factores de cada subíndice dentro de su fórmula. Identifique qué factor tiene el mayor valor.  3 Divida cada subíndice por el mayor factor común. Para obtener cada subíndice en su forma más simple, deberá dividir todos los subíndices presentes en la fórmula por el GCF que acaba de encontrar.
3 Divida cada subíndice por el mayor factor común. Para obtener cada subíndice en su forma más simple, deberá dividir todos los subíndices presentes en la fórmula por el GCF que acaba de encontrar.  4 Escribe la respuesta final. Reemplace sus subíndices originales con sus valores simplificados. Al hacerlo, ha determinado la fórmula empírica del compuesto a partir de su fórmula molecular.
4 Escribe la respuesta final. Reemplace sus subíndices originales con sus valores simplificados. Al hacerlo, ha determinado la fórmula empírica del compuesto a partir de su fórmula molecular.