La densidad se define como la cantidad de masa presente en un volumen dado. Para sólidos y líquidos, esta es una medida bastante sencilla. Sin embargo, los gases son extremadamente sensibles a la temperatura y la presión (más que los sólidos o líquidos), lo que puede hacer que sus densidades cambien con bastante rapidez. Si está determinando la densidad de forma experimental, deberá tener en cuenta esta temperatura y sensibilidad a la presión. Si tiene la intención de encontrar la densidad teórica de un gas, necesitará utilizar la Ley de Gas Ideal para tener en cuenta todas las variables.
Método uno de tres:
Determinar la densidad del gas experimentalmente
-
 1 Llena un globo Un globo está diseñado para inflarse con gas, lo que lo convierte en el recipiente perfecto para que usted almacene una cantidad fija de gas. Puede llenar el globo con aire usando una bomba, o puede elegir otro tipo de gas como helio o nitrógeno. Una vez que se llena el globo, ate el extremo para que no se escape el gas.[1]
1 Llena un globo Un globo está diseñado para inflarse con gas, lo que lo convierte en el recipiente perfecto para que usted almacene una cantidad fija de gas. Puede llenar el globo con aire usando una bomba, o puede elegir otro tipo de gas como helio o nitrógeno. Una vez que se llena el globo, ate el extremo para que no se escape el gas.[1] -
 2 Sumerge el globo completamente en un recipiente transparente. Luego, sumerge el globo en un recipiente de agua. El globo hará que el nivel del agua suba. Marque la nueva altura del agua y retire el globo.[2]
2 Sumerge el globo completamente en un recipiente transparente. Luego, sumerge el globo en un recipiente de agua. El globo hará que el nivel del agua suba. Marque la nueva altura del agua y retire el globo.[2] -
 3 Mida la cantidad de agua desplazada. Use un instrumento de medición (por ejemplo, una taza o un vaso de precipitados) para medir la cantidad de agua necesaria para llenar el recipiente hasta la marca (sin el globo en el agua). Verter lentamente Si viertes demasiado, tendrás que comenzar de nuevo. El volumen del globo es igual al volumen del agua que agrega. Registre este valor para un uso posterior como V.[3]
3 Mida la cantidad de agua desplazada. Use un instrumento de medición (por ejemplo, una taza o un vaso de precipitados) para medir la cantidad de agua necesaria para llenar el recipiente hasta la marca (sin el globo en el agua). Verter lentamente Si viertes demasiado, tendrás que comenzar de nuevo. El volumen del globo es igual al volumen del agua que agrega. Registre este valor para un uso posterior como V.[3] - Puede ahorrar tiempo sumergiendo el globo en un vaso de precipitados grande u otro contenedor previamente medido. Luego puede omitir la adición de agua y simplemente restar el volumen del agua del volumen del agua y el globo.
-
 4 Pese el globo lleno de gas. Puedes pesar el globo usando una escala sensible. Las básculas eléctricas suelen ser las mejores para esta aplicación. Registre el peso del globo lleno de gas para su uso posterior como mGB.[4]
4 Pese el globo lleno de gas. Puedes pesar el globo usando una escala sensible. Las básculas eléctricas suelen ser las mejores para esta aplicación. Registre el peso del globo lleno de gas para su uso posterior como mGB.[4] - Si está llenando el globo con un gas que es más liviano que el aire, deberá pesar la toma antes y después de llenar el globo para determinar la cantidad de gas utilizado.
-
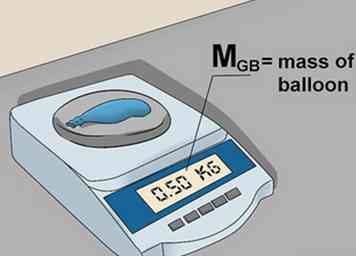 5 Encuentra la masa del globo vacío. Haz un agujero en el globo. Esto permitirá que el gas escape. Pese el globo nuevamente y registre el peso del globo vacío como msegundo.[5]
5 Encuentra la masa del globo vacío. Haz un agujero en el globo. Esto permitirá que el gas escape. Pese el globo nuevamente y registre el peso del globo vacío como msegundo.[5] -
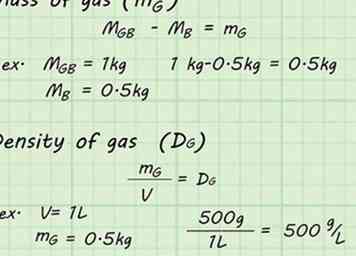 6 Haz los cálculos Ahora que tiene suficientes datos, puede calcular la densidad del gas dentro del globo. Reste el peso del globo vacío, msegundo, del peso del globo lleno, mGB. Esto le dará la masa del gas solo, mGRAMO. Divida la masa del gas, mGRAMO, por el volumen, V, del gas para encontrar la densidad del gas, DGRAMO.[6]
6 Haz los cálculos Ahora que tiene suficientes datos, puede calcular la densidad del gas dentro del globo. Reste el peso del globo vacío, msegundo, del peso del globo lleno, mGB. Esto le dará la masa del gas solo, mGRAMO. Divida la masa del gas, mGRAMO, por el volumen, V, del gas para encontrar la densidad del gas, DGRAMO.[6] - metroGB - msegundo = mGRAMO
- Por ejemplo, si el globo lleno tenía una masa de 1 kg y el balón vacío tenía una masa de 0.5 kg, la masa del gas (mGRAMO) se encontraría por: 1 kg - 0.5 kg = 0.5 kg.
- metroGRAMO / V = DGRAMO
- Por ejemplo, si el globo desplazó 1 L de agua, la densidad se puede encontrar dividiendo la masa por ese volumen: 500 g / 1 L = 500 g / L
- metroGB - msegundo = mGRAMO
Método dos de tres:
Encontrar la densidad teórica de un gas
-
 1 Comprenda la Ley de Gas Ideal. Debe saber que la Ley de Gas Ideal es una herramienta teórica que rige el comportamiento de los gases en condiciones específicas. Puedes resumirlo en la ecuación PV = nRT. Esto simplemente significa que la presión (P) multiplicada por el volumen (V) es igual al número de moles (n) multiplicado por la constante de gas ideal (R) multiplicada por la temperatura absoluta (T) para un gas ideal. [7]
1 Comprenda la Ley de Gas Ideal. Debe saber que la Ley de Gas Ideal es una herramienta teórica que rige el comportamiento de los gases en condiciones específicas. Puedes resumirlo en la ecuación PV = nRT. Esto simplemente significa que la presión (P) multiplicada por el volumen (V) es igual al número de moles (n) multiplicado por la constante de gas ideal (R) multiplicada por la temperatura absoluta (T) para un gas ideal. [7] - Un mol (n) es igual a 6.022 * 10 ^ 23 moléculas de gas.
- La constante de gas ideal (R) es 0.0821 L · atm / mol · K.
- La temperatura absoluta se mide en Kelvins (K).
-
 2 Suponga temperatura y presión estándar. La temperatura y presión estándar, o STP, se define como 273 K (32 ° F) (0 ° C) y 1 atmósfera estándar (1.0 bar). Suponiendo que STP le permite calcular el volumen de 1 mol de cualquier gas para que sea 22.414 litros. Conocer este volumen será imprescindible para encontrar la densidad de su gas.[8]
2 Suponga temperatura y presión estándar. La temperatura y presión estándar, o STP, se define como 273 K (32 ° F) (0 ° C) y 1 atmósfera estándar (1.0 bar). Suponiendo que STP le permite calcular el volumen de 1 mol de cualquier gas para que sea 22.414 litros. Conocer este volumen será imprescindible para encontrar la densidad de su gas.[8] -
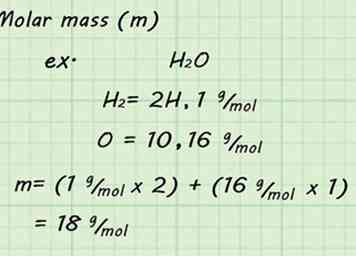 3 Encuentra la masa molar del gas. Como está utilizando STP y asumiendo una mol de gas, encontrar la masa molar será fácil. Agregue la masa molar de todos los átomos individuales que componen su gas para encontrar la masa molar del gas. Las masas atómicas se pueden encontrar en la tabla periódica.[9]
3 Encuentra la masa molar del gas. Como está utilizando STP y asumiendo una mol de gas, encontrar la masa molar será fácil. Agregue la masa molar de todos los átomos individuales que componen su gas para encontrar la masa molar del gas. Las masas atómicas se pueden encontrar en la tabla periódica.[9] - Por ejemplo, encontrar la masa molar de H2O gas significaría agregar las masas de 2 hidrógenos y 1 de oxígeno. La masa molar resultante sería 18 g / mol (1 g / mol + 1 g / mol + 16 g / mol).
-
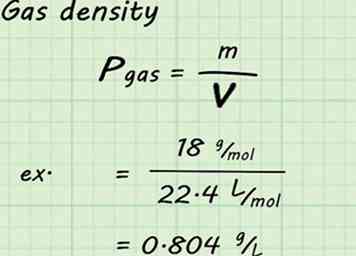 4 Calcule la densidad del gas. Aunque el volumen y moles de gas se fijan en estos cálculos, la masa molar es diferente para cada gas. Eso significa que la densidad será diferente para cada gas también. Para encontrar una densidad de gas dada, divida la masa molar del gas por el volumen molar (22.4 L / mol en este caso).[10]
4 Calcule la densidad del gas. Aunque el volumen y moles de gas se fijan en estos cálculos, la masa molar es diferente para cada gas. Eso significa que la densidad será diferente para cada gas también. Para encontrar una densidad de gas dada, divida la masa molar del gas por el volumen molar (22.4 L / mol en este caso).[10] - Por ejemplo, si estuviera buscando la densidad del vapor de agua, dividiría 18 g / mol por 22.4 l / mol para producir 0.804 g / l. Es decir: 18 g / mol / 22.4 L / mol = 0.804 g / L.
Método tres de tres:
Encontrar la densidad teórica de una mezcla de gas
-
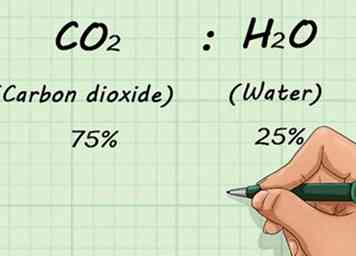 1 Conozca la descomposición fraccional de la mezcla de gases. Si ha mezclado dos o más gases, necesitará saber qué cantidad de cada gas está presente. Esto se hace sobre una base porcentual. Eso le permite conocer las proporciones de la mezcla, independientemente de la cantidad de gas presente en general.[11]
1 Conozca la descomposición fraccional de la mezcla de gases. Si ha mezclado dos o más gases, necesitará saber qué cantidad de cada gas está presente. Esto se hace sobre una base porcentual. Eso le permite conocer las proporciones de la mezcla, independientemente de la cantidad de gas presente en general.[11] - Por ejemplo, si tenía una mezcla de 75% de CO2 (dióxido de carbono) y 25% H2O (agua), esas relaciones no cambiarían si tiene 1 L o 1,000 L de gas.
-
 2 Encuentra la masa de un mol. Al conocer la proporción de tus gases, puedes encontrar la masa molar de tu mezcla. Deberá encontrar la masa molar de cada gas y multiplicarla por su composición porcentual en la mezcla. Luego, agregue todos los productos para encontrar la masa molar de la mezcla de gases.[12]
2 Encuentra la masa de un mol. Al conocer la proporción de tus gases, puedes encontrar la masa molar de tu mezcla. Deberá encontrar la masa molar de cada gas y multiplicarla por su composición porcentual en la mezcla. Luego, agregue todos los productos para encontrar la masa molar de la mezcla de gases.[12] - Por ejemplo, encontraría la masa molar de CO2 (44 g / mol) y multiplíquelo por 0.75. A continuación, encontrará la masa molar de H2O (18 g / mol) y multiplíquelo por 0.25. Cuando agrega estos productos juntos, 33 g / mol + 4.5 g / mol, cede la masa molar de su mezcla. En este caso, la masa molar es 37.5 g / mol.
-
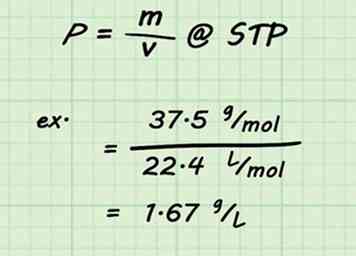 3 Divide por el volumen. Una vez que la masa molar se ha establecido para su mezcla, encontrar la densidad del gas es un cálculo simple. Divida la masa molar por el volumen estándar (22.4 L / mol). Recuerde que está asumiendo STP y 1 mol de gas.[13]
3 Divide por el volumen. Una vez que la masa molar se ha establecido para su mezcla, encontrar la densidad del gas es un cálculo simple. Divida la masa molar por el volumen estándar (22.4 L / mol). Recuerde que está asumiendo STP y 1 mol de gas.[13] - Por ejemplo, la densidad de una mezcla de 75% de dióxido de carbono y 25% de agua sería .
- Debe aplicar la fórmula de Ley de Gas Ideal para sus cálculos si el gas no está en STP (PV = nRT).
 Minotauromaquia
Minotauromaquia
 1 Llena un globo Un globo está diseñado para inflarse con gas, lo que lo convierte en el recipiente perfecto para que usted almacene una cantidad fija de gas. Puede llenar el globo con aire usando una bomba, o puede elegir otro tipo de gas como helio o nitrógeno. Una vez que se llena el globo, ate el extremo para que no se escape el gas.[1]
1 Llena un globo Un globo está diseñado para inflarse con gas, lo que lo convierte en el recipiente perfecto para que usted almacene una cantidad fija de gas. Puede llenar el globo con aire usando una bomba, o puede elegir otro tipo de gas como helio o nitrógeno. Una vez que se llena el globo, ate el extremo para que no se escape el gas.[1]  2 Sumerge el globo completamente en un recipiente transparente. Luego, sumerge el globo en un recipiente de agua. El globo hará que el nivel del agua suba. Marque la nueva altura del agua y retire el globo.[2]
2 Sumerge el globo completamente en un recipiente transparente. Luego, sumerge el globo en un recipiente de agua. El globo hará que el nivel del agua suba. Marque la nueva altura del agua y retire el globo.[2]  3 Mida la cantidad de agua desplazada. Use un instrumento de medición (por ejemplo, una taza o un vaso de precipitados) para medir la cantidad de agua necesaria para llenar el recipiente hasta la marca (sin el globo en el agua). Verter lentamente Si viertes demasiado, tendrás que comenzar de nuevo. El volumen del globo es igual al volumen del agua que agrega. Registre este valor para un uso posterior como V.[3]
3 Mida la cantidad de agua desplazada. Use un instrumento de medición (por ejemplo, una taza o un vaso de precipitados) para medir la cantidad de agua necesaria para llenar el recipiente hasta la marca (sin el globo en el agua). Verter lentamente Si viertes demasiado, tendrás que comenzar de nuevo. El volumen del globo es igual al volumen del agua que agrega. Registre este valor para un uso posterior como V.[3]  4 Pese el globo lleno de gas. Puedes pesar el globo usando una escala sensible. Las básculas eléctricas suelen ser las mejores para esta aplicación. Registre el peso del globo lleno de gas para su uso posterior como mGB.[4]
4 Pese el globo lleno de gas. Puedes pesar el globo usando una escala sensible. Las básculas eléctricas suelen ser las mejores para esta aplicación. Registre el peso del globo lleno de gas para su uso posterior como mGB.[4]  5 Encuentra la masa del globo vacío. Haz un agujero en el globo. Esto permitirá que el gas escape. Pese el globo nuevamente y registre el peso del globo vacío como msegundo.[5]
5 Encuentra la masa del globo vacío. Haz un agujero en el globo. Esto permitirá que el gas escape. Pese el globo nuevamente y registre el peso del globo vacío como msegundo.[5] 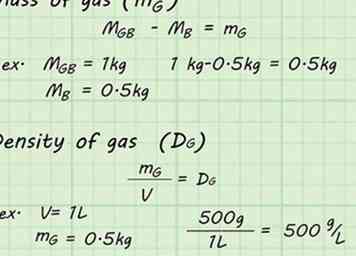 6 Haz los cálculos Ahora que tiene suficientes datos, puede calcular la densidad del gas dentro del globo. Reste el peso del globo vacío, msegundo, del peso del globo lleno, mGB. Esto le dará la masa del gas solo, mGRAMO. Divida la masa del gas, mGRAMO, por el volumen, V, del gas para encontrar la densidad del gas, DGRAMO.[6]
6 Haz los cálculos Ahora que tiene suficientes datos, puede calcular la densidad del gas dentro del globo. Reste el peso del globo vacío, msegundo, del peso del globo lleno, mGB. Esto le dará la masa del gas solo, mGRAMO. Divida la masa del gas, mGRAMO, por el volumen, V, del gas para encontrar la densidad del gas, DGRAMO.[6]  1 Comprenda la Ley de Gas Ideal. Debe saber que la Ley de Gas Ideal es una herramienta teórica que rige el comportamiento de los gases en condiciones específicas. Puedes resumirlo en la ecuación PV = nRT. Esto simplemente significa que la presión (P) multiplicada por el volumen (V) es igual al número de moles (n) multiplicado por la constante de gas ideal (R) multiplicada por la temperatura absoluta (T) para un gas ideal. [7]
1 Comprenda la Ley de Gas Ideal. Debe saber que la Ley de Gas Ideal es una herramienta teórica que rige el comportamiento de los gases en condiciones específicas. Puedes resumirlo en la ecuación PV = nRT. Esto simplemente significa que la presión (P) multiplicada por el volumen (V) es igual al número de moles (n) multiplicado por la constante de gas ideal (R) multiplicada por la temperatura absoluta (T) para un gas ideal. [7]  2 Suponga temperatura y presión estándar. La temperatura y presión estándar, o STP, se define como 273 K (32 ° F) (0 ° C) y 1 atmósfera estándar (1.0 bar). Suponiendo que STP le permite calcular el volumen de 1 mol de cualquier gas para que sea 22.414 litros. Conocer este volumen será imprescindible para encontrar la densidad de su gas.[8]
2 Suponga temperatura y presión estándar. La temperatura y presión estándar, o STP, se define como 273 K (32 ° F) (0 ° C) y 1 atmósfera estándar (1.0 bar). Suponiendo que STP le permite calcular el volumen de 1 mol de cualquier gas para que sea 22.414 litros. Conocer este volumen será imprescindible para encontrar la densidad de su gas.[8] 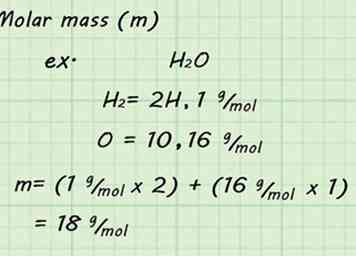 3 Encuentra la masa molar del gas. Como está utilizando STP y asumiendo una mol de gas, encontrar la masa molar será fácil. Agregue la masa molar de todos los átomos individuales que componen su gas para encontrar la masa molar del gas. Las masas atómicas se pueden encontrar en la tabla periódica.[9]
3 Encuentra la masa molar del gas. Como está utilizando STP y asumiendo una mol de gas, encontrar la masa molar será fácil. Agregue la masa molar de todos los átomos individuales que componen su gas para encontrar la masa molar del gas. Las masas atómicas se pueden encontrar en la tabla periódica.[9] 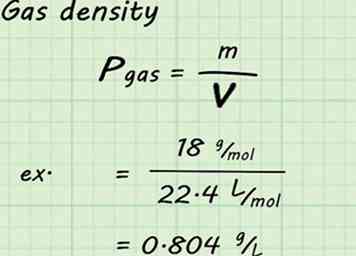 4 Calcule la densidad del gas. Aunque el volumen y moles de gas se fijan en estos cálculos, la masa molar es diferente para cada gas. Eso significa que la densidad será diferente para cada gas también. Para encontrar una densidad de gas dada, divida la masa molar del gas por el volumen molar (22.4 L / mol en este caso).[10]
4 Calcule la densidad del gas. Aunque el volumen y moles de gas se fijan en estos cálculos, la masa molar es diferente para cada gas. Eso significa que la densidad será diferente para cada gas también. Para encontrar una densidad de gas dada, divida la masa molar del gas por el volumen molar (22.4 L / mol en este caso).[10] 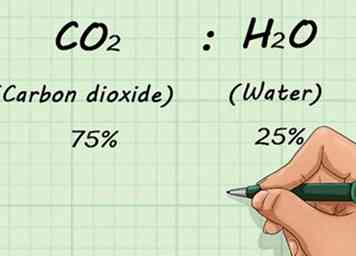 1 Conozca la descomposición fraccional de la mezcla de gases. Si ha mezclado dos o más gases, necesitará saber qué cantidad de cada gas está presente. Esto se hace sobre una base porcentual. Eso le permite conocer las proporciones de la mezcla, independientemente de la cantidad de gas presente en general.[11]
1 Conozca la descomposición fraccional de la mezcla de gases. Si ha mezclado dos o más gases, necesitará saber qué cantidad de cada gas está presente. Esto se hace sobre una base porcentual. Eso le permite conocer las proporciones de la mezcla, independientemente de la cantidad de gas presente en general.[11]  2 Encuentra la masa de un mol. Al conocer la proporción de tus gases, puedes encontrar la masa molar de tu mezcla. Deberá encontrar la masa molar de cada gas y multiplicarla por su composición porcentual en la mezcla. Luego, agregue todos los productos para encontrar la masa molar de la mezcla de gases.[12]
2 Encuentra la masa de un mol. Al conocer la proporción de tus gases, puedes encontrar la masa molar de tu mezcla. Deberá encontrar la masa molar de cada gas y multiplicarla por su composición porcentual en la mezcla. Luego, agregue todos los productos para encontrar la masa molar de la mezcla de gases.[12] 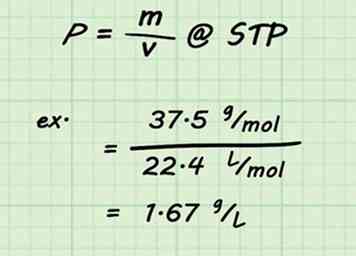 3 Divide por el volumen. Una vez que la masa molar se ha establecido para su mezcla, encontrar la densidad del gas es un cálculo simple. Divida la masa molar por el volumen estándar (22.4 L / mol). Recuerde que está asumiendo STP y 1 mol de gas.[13]
3 Divide por el volumen. Una vez que la masa molar se ha establecido para su mezcla, encontrar la densidad del gas es un cálculo simple. Divida la masa molar por el volumen estándar (22.4 L / mol). Recuerde que está asumiendo STP y 1 mol de gas.[13]