La prueba del pH del agua le indica qué tan ácida o básica es el agua en el momento de la prueba. El agua pura no contaminada normalmente tiene un nivel de pH de 7, que es neutra (ni ácida ni básica). El nivel de pH del agua puede proporcionar información sobre la posible contaminación y puede ser una precaución importante para proteger la salud de las personas, los animales y la vegetación.
Método uno de tres:
Usando un medidor de pH
-
 1 Calibre la sonda y el medidor siguiendo las especificaciones del fabricante. Es posible que necesite calibrar el medidor probándolo en una sustancia con una clasificación de pH conocida. Luego puede ajustar el medidor en consecuencia. Si va a analizar el agua de un laboratorio, es posible que desee realizar esta calibración varias horas antes de llevar el medidor al campo.[1]
1 Calibre la sonda y el medidor siguiendo las especificaciones del fabricante. Es posible que necesite calibrar el medidor probándolo en una sustancia con una clasificación de pH conocida. Luego puede ajustar el medidor en consecuencia. Si va a analizar el agua de un laboratorio, es posible que desee realizar esta calibración varias horas antes de llevar el medidor al campo.[1] - Enjuague la sonda con agua doble desionizada antes de usarla. Secarlo con un pañuelo limpio.
-
 2 Recoge una muestra del agua en un recipiente limpio. La muestra de agua debe ser lo suficientemente profunda para cubrir la punta del electrodo. Deje la muestra reposar por un momento para que la temperatura se estabilice, luego mida la temperatura de la muestra con un termómetro.
2 Recoge una muestra del agua en un recipiente limpio. La muestra de agua debe ser lo suficientemente profunda para cubrir la punta del electrodo. Deje la muestra reposar por un momento para que la temperatura se estabilice, luego mida la temperatura de la muestra con un termómetro. -
 3 Ajuste el medidor para que coincida con la temperatura de la muestra. La sensibilidad del sensor se ve afectada por la temperatura del agua, por lo que la lectura del medidor no puede ser precisa si no ingresa los datos de temperatura.[2] El pH del agua también se verá afectado por la temperatura del agua: el agua pura tiene un pH más bajo a temperaturas más altas y un pH más alto a temperaturas más bajas.[3]
3 Ajuste el medidor para que coincida con la temperatura de la muestra. La sensibilidad del sensor se ve afectada por la temperatura del agua, por lo que la lectura del medidor no puede ser precisa si no ingresa los datos de temperatura.[2] El pH del agua también se verá afectado por la temperatura del agua: el agua pura tiene un pH más bajo a temperaturas más altas y un pH más alto a temperaturas más bajas.[3] -
 4 Coloque la sonda en la muestra. Espere a que el medidor llegue al equilibrio. El medidor ha alcanzado el equilibrio cuando la medición se estabiliza.
4 Coloque la sonda en la muestra. Espere a que el medidor llegue al equilibrio. El medidor ha alcanzado el equilibrio cuando la medición se estabiliza. -
 5 Lea la medición de pH de la muestra. Su medidor de pH debe proporcionar una lectura en la escala de 0-14. Si el agua es pura, debe leer cerca de 7. Registre sus hallazgos.
5 Lea la medición de pH de la muestra. Su medidor de pH debe proporcionar una lectura en la escala de 0-14. Si el agua es pura, debe leer cerca de 7. Registre sus hallazgos. - Una lectura de pH inferior a 7 indica que el agua es ácida, mientras que una lectura superior a 7 indica que el agua es básica.
Método dos de tres:
Uso de Litmus Papers
-
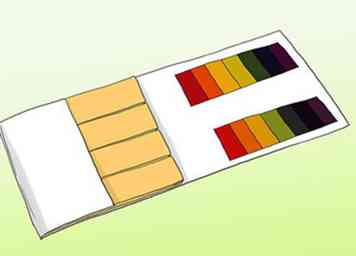 1 Conozca la diferencia entre el papel de pH y el papel de tornasol. Para obtener una lectura precisa de una solución, puede usar papel pH. Esto no debe confundirse con el papel de tornasol común. Ambos pueden usarse para probar ácidos y bases, pero difieren en formas importantes.[4] El papel pH le indicará el valor real del pH del agua, pero las tiras de tornasol típicamente solo indican si el agua es básica o ácida.[5]
1 Conozca la diferencia entre el papel de pH y el papel de tornasol. Para obtener una lectura precisa de una solución, puede usar papel pH. Esto no debe confundirse con el papel de tornasol común. Ambos pueden usarse para probar ácidos y bases, pero difieren en formas importantes.[4] El papel pH le indicará el valor real del pH del agua, pero las tiras de tornasol típicamente solo indican si el agua es básica o ácida.[5] - Las tiras de pH contienen una serie de barras indicadoras que cambiarán de color después de la exposición a una solución. La fuerza de los ácidos y bases en cada barra es diferente. Después de que cambien, el patrón de color de las barras se puede combinar con los ejemplos que vienen con el kit.
- Los papeles de tornasol son tiras de papel que contienen un ácido o una base (alcalina). Los más comunes son el rojo (que contiene un ácido que reacciona con las bases) y el azul (que contiene una base que reacciona con los ácidos). Las tiras rojas se vuelven azules si la sustancia es alcalina, y las tiras azules se vuelven rojas si entran en contacto con un ácido. Los papeles de tornasol se pueden usar para proporcionar una prueba rápida y fácil, pero los más baratos de ellos no siempre proporcionan lecturas precisas sobre la fuerza de la solución.
-
 2 Recoge una muestra del agua en un recipiente limpio. La muestra de agua debe ser lo suficientemente profunda para cubrir la tira reactiva.
2 Recoge una muestra del agua en un recipiente limpio. La muestra de agua debe ser lo suficientemente profunda para cubrir la tira reactiva. -
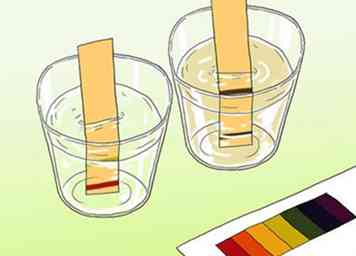
 3 Sumerge una tira de prueba en tu muestra. Tan solo unos segundos de exposición serán suficientes. Las diferentes barras indicadoras en el papel comenzarán a cambiar de color en unos momentos.
3 Sumerge una tira de prueba en tu muestra. Tan solo unos segundos de exposición serán suficientes. Las diferentes barras indicadoras en el papel comenzarán a cambiar de color en unos momentos. -
 4 Compare la tira de prueba con la tabla de colores que viene con el papel. El (los) color (es) en el cuadro deben coincidir con el (los) color (es) de su tira reactiva. La tabla debe correlacionar los patrones de color con los niveles de pH.
4 Compare la tira de prueba con la tabla de colores que viene con el papel. El (los) color (es) en el cuadro deben coincidir con el (los) color (es) de su tira reactiva. La tabla debe correlacionar los patrones de color con los niveles de pH.
Método tres de tres:
Comprender el pH
-
 1 Aprende cómo se definen los ácidos y las bases. La acidez y la alcalinidad (el término utilizado para describir las bases) se definen por los iones de hidrógeno que pierden o aceptan. Un ácido es una sustancia que pierde (o, algunos dicen, dona) iones de hidrógeno. Una base es una sustancia que acepta iones de hidrógeno adicionales.
1 Aprende cómo se definen los ácidos y las bases. La acidez y la alcalinidad (el término utilizado para describir las bases) se definen por los iones de hidrógeno que pierden o aceptan. Un ácido es una sustancia que pierde (o, algunos dicen, dona) iones de hidrógeno. Una base es una sustancia que acepta iones de hidrógeno adicionales. -
 2 Familiarícese con la escala de pH. El número de pH se usa para evaluar el nivel de acidez o alcalinidad de las sustancias solubles en agua. El agua normalmente contiene una cantidad igual de iones hidróxido (OH-) e iones hidronio (H30 +). Cuando se agrega una sustancia ácida o alcalina al agua, cambian la proporción de iones hidróxido e hidronio.[6]
2 Familiarícese con la escala de pH. El número de pH se usa para evaluar el nivel de acidez o alcalinidad de las sustancias solubles en agua. El agua normalmente contiene una cantidad igual de iones hidróxido (OH-) e iones hidronio (H30 +). Cuando se agrega una sustancia ácida o alcalina al agua, cambian la proporción de iones hidróxido e hidronio.[6] - El pH generalmente se mide en una escala de 0 a 14 (aunque las sustancias pueden realmente estar más allá de ese rango). Las sustancias neutras tienen una tasa cercana a 7, las ácidas por debajo de 7 y las alcalinas por encima de 7.
- La escala de pH es una escala logarítmica, lo que significa que las diferencias de un solo entero en realidad representan una diferencia diez veces mayor en acidez o alcalinidad. Por ejemplo, una sustancia que tiene un pH de 2 es en realidad 10 veces más ácida que una con un pH de 3 y 100 veces más ácida que una sustancia con un pH de 4. La escala funciona de manera similar para sustancias alcalinas, con 1 entero que representa una diferencia de diez veces en la alcalinidad.
-
 3 Conozca por qué probamos el pH del agua. El agua pura debe tener un pH de 7, aunque el agua del grifo común tiene un pH entre 6 y 5,5. El agua altamente ácida (agua con un pH bajo) es más probable que disuelva los productos químicos tóxicos. Estos pueden contaminar el agua y hacerla insegura para el consumo humano.[7]
3 Conozca por qué probamos el pH del agua. El agua pura debe tener un pH de 7, aunque el agua del grifo común tiene un pH entre 6 y 5,5. El agua altamente ácida (agua con un pH bajo) es más probable que disuelva los productos químicos tóxicos. Estos pueden contaminar el agua y hacerla insegura para el consumo humano.[7] - A menudo se considera mejor para probar el pH en el sitio. Si recoge una muestra de agua para estudiar en un laboratorio, el dióxido de carbono en el aire puede disolverse en el agua. El dióxido de carbono disuelto reacciona con los iones en el agua para aumentar la acidez en soluciones básicas o neutras. Para evitar la contaminación por dióxido de carbono, debe analizar el agua dentro de las 2 horas de la recolección.[8]
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Calibre la sonda y el medidor siguiendo las especificaciones del fabricante. Es posible que necesite calibrar el medidor probándolo en una sustancia con una clasificación de pH conocida. Luego puede ajustar el medidor en consecuencia. Si va a analizar el agua de un laboratorio, es posible que desee realizar esta calibración varias horas antes de llevar el medidor al campo.[1]
1 Calibre la sonda y el medidor siguiendo las especificaciones del fabricante. Es posible que necesite calibrar el medidor probándolo en una sustancia con una clasificación de pH conocida. Luego puede ajustar el medidor en consecuencia. Si va a analizar el agua de un laboratorio, es posible que desee realizar esta calibración varias horas antes de llevar el medidor al campo.[1]  2 Recoge una muestra del agua en un recipiente limpio. La muestra de agua debe ser lo suficientemente profunda para cubrir la punta del electrodo. Deje la muestra reposar por un momento para que la temperatura se estabilice, luego mida la temperatura de la muestra con un termómetro.
2 Recoge una muestra del agua en un recipiente limpio. La muestra de agua debe ser lo suficientemente profunda para cubrir la punta del electrodo. Deje la muestra reposar por un momento para que la temperatura se estabilice, luego mida la temperatura de la muestra con un termómetro.  3 Ajuste el medidor para que coincida con la temperatura de la muestra. La sensibilidad del sensor se ve afectada por la temperatura del agua, por lo que la lectura del medidor no puede ser precisa si no ingresa los datos de temperatura.[2] El pH del agua también se verá afectado por la temperatura del agua: el agua pura tiene un pH más bajo a temperaturas más altas y un pH más alto a temperaturas más bajas.[3]
3 Ajuste el medidor para que coincida con la temperatura de la muestra. La sensibilidad del sensor se ve afectada por la temperatura del agua, por lo que la lectura del medidor no puede ser precisa si no ingresa los datos de temperatura.[2] El pH del agua también se verá afectado por la temperatura del agua: el agua pura tiene un pH más bajo a temperaturas más altas y un pH más alto a temperaturas más bajas.[3]  4 Coloque la sonda en la muestra. Espere a que el medidor llegue al equilibrio. El medidor ha alcanzado el equilibrio cuando la medición se estabiliza.
4 Coloque la sonda en la muestra. Espere a que el medidor llegue al equilibrio. El medidor ha alcanzado el equilibrio cuando la medición se estabiliza.  5 Lea la medición de pH de la muestra. Su medidor de pH debe proporcionar una lectura en la escala de 0-14. Si el agua es pura, debe leer cerca de 7. Registre sus hallazgos.
5 Lea la medición de pH de la muestra. Su medidor de pH debe proporcionar una lectura en la escala de 0-14. Si el agua es pura, debe leer cerca de 7. Registre sus hallazgos.  1 Conozca la diferencia entre el papel de pH y el papel de tornasol. Para obtener una lectura precisa de una solución, puede usar papel pH. Esto no debe confundirse con el papel de tornasol común. Ambos pueden usarse para probar ácidos y bases, pero difieren en formas importantes.[4] El papel pH le indicará el valor real del pH del agua, pero las tiras de tornasol típicamente solo indican si el agua es básica o ácida.[5]
1 Conozca la diferencia entre el papel de pH y el papel de tornasol. Para obtener una lectura precisa de una solución, puede usar papel pH. Esto no debe confundirse con el papel de tornasol común. Ambos pueden usarse para probar ácidos y bases, pero difieren en formas importantes.[4] El papel pH le indicará el valor real del pH del agua, pero las tiras de tornasol típicamente solo indican si el agua es básica o ácida.[5]  2 Recoge una muestra del agua en un recipiente limpio. La muestra de agua debe ser lo suficientemente profunda para cubrir la tira reactiva.
2 Recoge una muestra del agua en un recipiente limpio. La muestra de agua debe ser lo suficientemente profunda para cubrir la tira reactiva.  3 Sumerge una tira de prueba en tu muestra. Tan solo unos segundos de exposición serán suficientes. Las diferentes barras indicadoras en el papel comenzarán a cambiar de color en unos momentos.
3 Sumerge una tira de prueba en tu muestra. Tan solo unos segundos de exposición serán suficientes. Las diferentes barras indicadoras en el papel comenzarán a cambiar de color en unos momentos.  4 Compare la tira de prueba con la tabla de colores que viene con el papel. El (los) color (es) en el cuadro deben coincidir con el (los) color (es) de su tira reactiva. La tabla debe correlacionar los patrones de color con los niveles de pH.
4 Compare la tira de prueba con la tabla de colores que viene con el papel. El (los) color (es) en el cuadro deben coincidir con el (los) color (es) de su tira reactiva. La tabla debe correlacionar los patrones de color con los niveles de pH.  1 Aprende cómo se definen los ácidos y las bases. La acidez y la alcalinidad (el término utilizado para describir las bases) se definen por los iones de hidrógeno que pierden o aceptan. Un ácido es una sustancia que pierde (o, algunos dicen, dona) iones de hidrógeno. Una base es una sustancia que acepta iones de hidrógeno adicionales.
1 Aprende cómo se definen los ácidos y las bases. La acidez y la alcalinidad (el término utilizado para describir las bases) se definen por los iones de hidrógeno que pierden o aceptan. Un ácido es una sustancia que pierde (o, algunos dicen, dona) iones de hidrógeno. Una base es una sustancia que acepta iones de hidrógeno adicionales.  2 Familiarícese con la escala de pH. El número de pH se usa para evaluar el nivel de acidez o alcalinidad de las sustancias solubles en agua. El agua normalmente contiene una cantidad igual de iones hidróxido (OH-) e iones hidronio (H30 +). Cuando se agrega una sustancia ácida o alcalina al agua, cambian la proporción de iones hidróxido e hidronio.[6]
2 Familiarícese con la escala de pH. El número de pH se usa para evaluar el nivel de acidez o alcalinidad de las sustancias solubles en agua. El agua normalmente contiene una cantidad igual de iones hidróxido (OH-) e iones hidronio (H30 +). Cuando se agrega una sustancia ácida o alcalina al agua, cambian la proporción de iones hidróxido e hidronio.[6]  3 Conozca por qué probamos el pH del agua. El agua pura debe tener un pH de 7, aunque el agua del grifo común tiene un pH entre 6 y 5,5. El agua altamente ácida (agua con un pH bajo) es más probable que disuelva los productos químicos tóxicos. Estos pueden contaminar el agua y hacerla insegura para el consumo humano.[7]
3 Conozca por qué probamos el pH del agua. El agua pura debe tener un pH de 7, aunque el agua del grifo común tiene un pH entre 6 y 5,5. El agua altamente ácida (agua con un pH bajo) es más probable que disuelva los productos químicos tóxicos. Estos pueden contaminar el agua y hacerla insegura para el consumo humano.[7]