Nombrar compuestos químicos básicos es esencial si quieres tener éxito en la química, ya que el nombre del compuesto define claramente lo que es. Cada tipo de compuesto tiene sus propias reglas para nombrarlo. Al nombrar compuestos, debe comprender estas reglas diferentes, así como también detectar las pistas que le ayudarán a nombrar correctamente los compuestos. Siga esta guía para conocer algunas reglas básicas sobre cómo los compuestos químicos obtienen su nombre y cómo aplicar nombres a compuestos con los que no está familiarizado.
Método uno de tres:
Nombrando compuestos iónicos
-
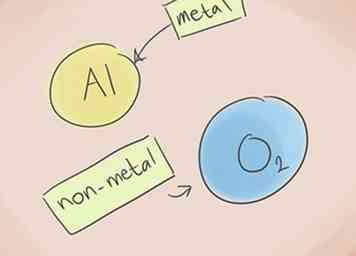 1 Sepa qué hace un compuesto iónico. Los compuestos iónicos contienen un metal y un no metal. Consulte la tabla periódica de elementos para ver a qué categorías pertenecen los elementos en el compuesto.[1]
1 Sepa qué hace un compuesto iónico. Los compuestos iónicos contienen un metal y un no metal. Consulte la tabla periódica de elementos para ver a qué categorías pertenecen los elementos en el compuesto.[1] -
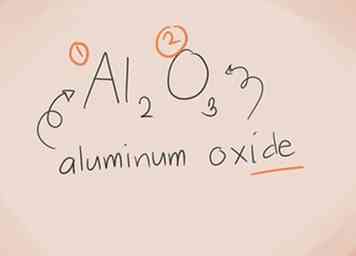 2 Construye el nombre Para un compuesto iónico de dos elementos, la denominación es simple. La primera parte del nombre es el nombre del elemento de metal. La segunda parte es el nombre del elemento no metálico, con el sufijo "-ide".[2]
2 Construye el nombre Para un compuesto iónico de dos elementos, la denominación es simple. La primera parte del nombre es el nombre del elemento de metal. La segunda parte es el nombre del elemento no metálico, con el sufijo "-ide".[2] - Aquí hay unos ejemplos:
- Alabama2O3. Alabama2 = Aluminio; O3 = Oxígeno Entonces el nombre sería "óxido de aluminio".
- FeCl3. Fe = hierro; Cl3 = Cloro. Entonces el nombre sería "cloruro de hierro".
- SnO2. Sn = estaño; O2 = Oxígeno Entonces el nombre de este compuesto sería óxido de estaño.
- Aquí hay unos ejemplos:
-
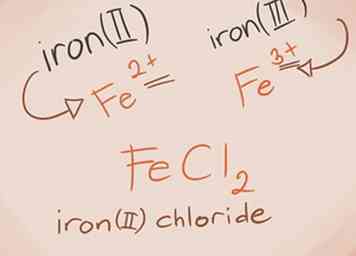 3 Reconoce y nombra los metales de transición. Los metales en los bloques D y F de la tabla periódica se conocen como metales de transición. Su carga está escrita con un número romano al escribir el nombre compuesto. Esto se debe a que pueden tener más de una carga y hacer más de un compuesto.[3]
3 Reconoce y nombra los metales de transición. Los metales en los bloques D y F de la tabla periódica se conocen como metales de transición. Su carga está escrita con un número romano al escribir el nombre compuesto. Esto se debe a que pueden tener más de una carga y hacer más de un compuesto.[3] - Ejemplo: FeCl2 y FeCl3. Fe = hierro; Cl2 = Cloruro -2; Cl3 = Cloruro -3. Los nombres serían cloruro de hierro (II) y cloruro de hierro (III).
Método dos de tres:
Denominación de compuestos poliatómicos
-
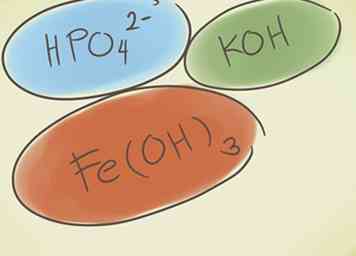 1 Comprender qué es un compuesto poliatómico Estos compuestos se forman a partir de grupos de átomos que están covalentemente unidos entre sí, y todo el grupo tiene una carga positiva o negativa.[4] Puedes hacer tres cosas básicas con los compuestos poliatómicos, que te ayudarán a identificar y comprender este tipo de compuestos:
1 Comprender qué es un compuesto poliatómico Estos compuestos se forman a partir de grupos de átomos que están covalentemente unidos entre sí, y todo el grupo tiene una carga positiva o negativa.[4] Puedes hacer tres cosas básicas con los compuestos poliatómicos, que te ayudarán a identificar y comprender este tipo de compuestos: - Agregue un hidrógeno al comienzo del compuesto. La palabra "hidrógeno" se agrega al comienzo del nombre del compuesto. Esto reduce la carga negativa en uno. Por ejemplo, "carbonato" CO32- se convierte en HCO "carbonato de hidrógeno"3-.

- Retire un oxígeno del compuesto. La carga se mantiene igual y el final del compuesto cambia de "-ate" a "-ite". Por ejemplo: NO3 a NO2 va de "nitrato" a "nitrito".

- Reemplace el átomo central con otro del mismo grupo periódico. Por ejemplo, sulfato SO42- puede convertirse en Selenate SeO42-.
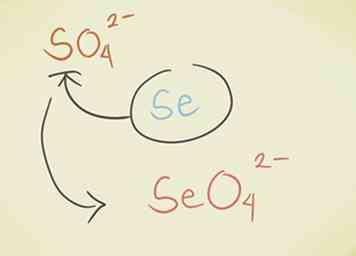
- Agregue un hidrógeno al comienzo del compuesto. La palabra "hidrógeno" se agrega al comienzo del nombre del compuesto. Esto reduce la carga negativa en uno. Por ejemplo, "carbonato" CO32- se convierte en HCO "carbonato de hidrógeno"3-.
-
 2 Memorice los grupos de iones más comunes. Estas son la base para formar la mayoría de los compuestos poliatómicos. Enumerados para aumentar la carga negativa, son:
2 Memorice los grupos de iones más comunes. Estas son la base para formar la mayoría de los compuestos poliatómicos. Enumerados para aumentar la carga negativa, son: - Ion hidróxido: OH-
- Ion de nitrato: NO3-
- Ion de carbonato de hidrógeno: HCO3-
- Ion permanganato: MnO4-
- Ion de carbonato: CO32-
- Ion cromado: CrO42-
- Ion dicromato: Cr2O72-
- Ion sulfato: SO42-
- Ion sulfito: SO32-
- Ion tiosulfato: S2O3<2-
- Ion fosfato: PO43-
- Ion de amonio: NH4+
- 3 Cree nombres compuestos basados en la lista. Asociar los elementos que se adjuntan al ion del grupo y el nombre en consecuencia. Si el elemento se encuentra delante del grupo de iones, el nombre del elemento simplemente se agrega al comienzo del nombre del compuesto.
- Ejemplo: KMnO4. Deberías reconocer el MnO4- ion como permanganato K es potasio, por lo que el compuesto se denomina permanganato de potasio.

- Ejemplo: NaOH. Deberías reconocer el OH- ion como hidróxido. Na es sodio, por lo que el compuesto se llama hidróxido de sodio.
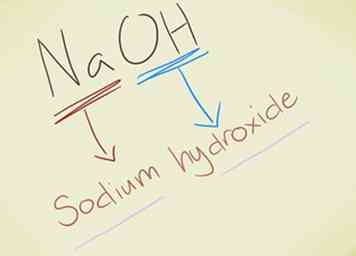
- Ejemplo: KMnO4. Deberías reconocer el MnO4- ion como permanganato K es potasio, por lo que el compuesto se denomina permanganato de potasio.
Método tres de tres:
Nombrando compuestos covalentes
-
 1 Comprenda un compuesto covalente. Los compuestos covalentes están formados por dos o más elementos no metálicos. El nombre del compuesto se basa en la cantidad de átomos presentes. El prefijo adjunto es el término latino para el número de moléculas.
1 Comprenda un compuesto covalente. Los compuestos covalentes están formados por dos o más elementos no metálicos. El nombre del compuesto se basa en la cantidad de átomos presentes. El prefijo adjunto es el término latino para el número de moléculas. -
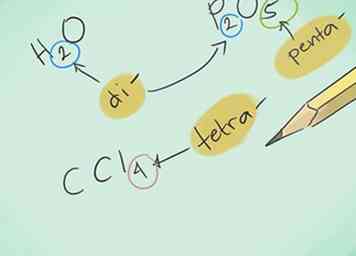 2 Aprende los prefijos. Memoriza los prefijos de hasta 10 átomos:
2 Aprende los prefijos. Memoriza los prefijos de hasta 10 átomos: - 1 átomo - "Mono-"
- 2 átomos - "Di-"
- 3 átomos - "Tri-"
- 4 átomos - "Tetra-"
- 5 átomos - "Penta-"
- 6 átomos - "Hexa-"
- 7 átomos - "Hepta-"
- 8 átomos - "Octa-"
- 9 átomos - "Nona-"
- 10 átomos - "Deca-"
- 3 Nombra los compuestos. Usando los prefijos correctos, nombra el nuevo compuesto. Adjunta prefijos a cualquier parte del compuesto que tenga múltiples átomos.
- Ejemplo: CO sería monóxido de carbono y CO2 sería dióxido de carbono.

- Ejemplo: N2S3 sería el trisulfuro de Dinitrogen.
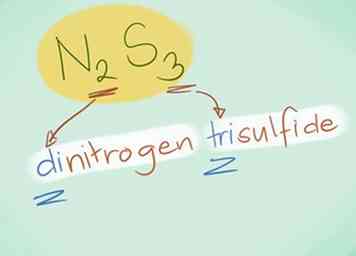
- En la mayoría de los casos, el prefijo "mono-" puede omitirse porque está implícito cuando no está presente. Todavía se usa para monóxido de carbono debido a que el término se usa desde principios de la química.

- Ejemplo: CO sería monóxido de carbono y CO2 sería dióxido de carbono.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Sepa qué hace un compuesto iónico. Los compuestos iónicos contienen un metal y un no metal. Consulte la tabla periódica de elementos para ver a qué categorías pertenecen los elementos en el compuesto.[1]
1 Sepa qué hace un compuesto iónico. Los compuestos iónicos contienen un metal y un no metal. Consulte la tabla periódica de elementos para ver a qué categorías pertenecen los elementos en el compuesto.[1] 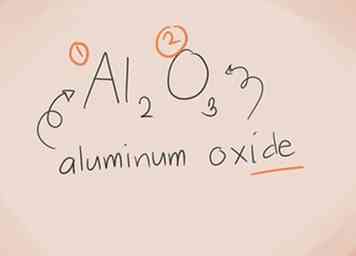 2 Construye el nombre Para un compuesto iónico de dos elementos, la denominación es simple. La primera parte del nombre es el nombre del elemento de metal. La segunda parte es el nombre del elemento no metálico, con el sufijo "-ide".[2]
2 Construye el nombre Para un compuesto iónico de dos elementos, la denominación es simple. La primera parte del nombre es el nombre del elemento de metal. La segunda parte es el nombre del elemento no metálico, con el sufijo "-ide".[2] 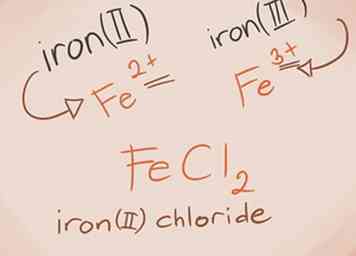 3 Reconoce y nombra los metales de transición. Los metales en los bloques D y F de la tabla periódica se conocen como metales de transición. Su carga está escrita con un número romano al escribir el nombre compuesto. Esto se debe a que pueden tener más de una carga y hacer más de un compuesto.[3]
3 Reconoce y nombra los metales de transición. Los metales en los bloques D y F de la tabla periódica se conocen como metales de transición. Su carga está escrita con un número romano al escribir el nombre compuesto. Esto se debe a que pueden tener más de una carga y hacer más de un compuesto.[3]  1 Comprender qué es un compuesto poliatómico Estos compuestos se forman a partir de grupos de átomos que están covalentemente unidos entre sí, y todo el grupo tiene una carga positiva o negativa.[4] Puedes hacer tres cosas básicas con los compuestos poliatómicos, que te ayudarán a identificar y comprender este tipo de compuestos:
1 Comprender qué es un compuesto poliatómico Estos compuestos se forman a partir de grupos de átomos que están covalentemente unidos entre sí, y todo el grupo tiene una carga positiva o negativa.[4] Puedes hacer tres cosas básicas con los compuestos poliatómicos, que te ayudarán a identificar y comprender este tipo de compuestos: 


 2 Memorice los grupos de iones más comunes. Estas son la base para formar la mayoría de los compuestos poliatómicos. Enumerados para aumentar la carga negativa, son:
2 Memorice los grupos de iones más comunes. Estas son la base para formar la mayoría de los compuestos poliatómicos. Enumerados para aumentar la carga negativa, son: 

 1 Comprenda un compuesto covalente. Los compuestos covalentes están formados por dos o más elementos no metálicos. El nombre del compuesto se basa en la cantidad de átomos presentes. El prefijo adjunto es el término latino para el número de moléculas.
1 Comprenda un compuesto covalente. Los compuestos covalentes están formados por dos o más elementos no metálicos. El nombre del compuesto se basa en la cantidad de átomos presentes. El prefijo adjunto es el término latino para el número de moléculas.  2 Aprende los prefijos. Memoriza los prefijos de hasta 10 átomos:
2 Aprende los prefijos. Memoriza los prefijos de hasta 10 átomos: 

