En química, una molécula es covalente cuando está formado por enlaces entre no metales.[1] Nombrar estos tipos de compuestos generalmente es una cuestión de conocer los nombres de los átomos en la molécula, así como el número de cada átomo. Existen ciertas reglas especiales para los ácidos y compuestos relacionados, que normalmente se reconocen por la presencia de uno o más átomos de hidrógeno al comienzo de la fórmula del compuesto.
Método uno de tres:
Aprendizaje de prefijos numéricos para compuestos covalentes
| Número | Prefijo griego | Ejemplo |
|---|---|---|
| 1 | Mono- | Carbón monoxide (CO) |
| 2 | Di- | Carbón dióxido (CO2) |
| 3 | Tri- | Fosforoso trihidruro (PH3) |
| 4 | Tetra- | Silicio tetrafluoruro (SiF4) |
| 5 | Penta- | Dinitrógeno encerradoóxido (N2O5) |
| 6 | Hexa- | Azufre hexacloruro (SCl6) |
| 7 | Hepta- | Yodo heptafluoruro (IF7) |
| 8 | Octa- | Tetranitrógeno octacloruro (N4Cl8) |
Método dos de tres:
Nombrando Compuestos Binarios Básicos
-
 1 Nombra el primer elemento en el compuesto. Las fórmulas moleculares se leen de izquierda a derecha, al igual que las palabras en inglés. Generalmente, el primer átomo (el 1 a la izquierda de la fórmula molecular) también es el átomo menos abundante en el compuesto. Escribe el nombre de este átomo primero.
1 Nombra el primer elemento en el compuesto. Las fórmulas moleculares se leen de izquierda a derecha, al igual que las palabras en inglés. Generalmente, el primer átomo (el 1 a la izquierda de la fórmula molecular) también es el átomo menos abundante en el compuesto. Escribe el nombre de este átomo primero. - Por ejemplo, en la fórmula molecular CF4, Carbon (C) es lo primero, entonces lo escribimos primero: "Carbón"
- Si solo conoce los átomos de la molécula y no conoce la fórmula molecular, no se preocupe. En los compuestos covalentes, el elemento que aparece primero en esta lista se escribe primero en la fórmula molecular:[3]
-
- B, Si, C, Sb, Como, P, N, H, Te, Se, S, I, Br, Cl, O, F
-
- Tenga en cuenta que hay una excepción: cuando el oxígeno se combina con un halógeno (un elemento del Período 7 como F, Cl, etc.), el halógeno es lo primero, como en el monóxido de cloro, que se escribe como ClO.[4]
-
 2 Escribe el prefijo griego para el número del segundo átomo. Luego, mira el segundo átomo en la molécula. Determine cuántas veces aparece en la molécula. Este es el número escrito en el subíndice junto a él en la fórmula molecular. Si no hay un número al lado del segundo átomo, aparece una vez. Encuentre el prefijo griego apropiado de la tabla anterior y escríbalo a continuación.
2 Escribe el prefijo griego para el número del segundo átomo. Luego, mira el segundo átomo en la molécula. Determine cuántas veces aparece en la molécula. Este es el número escrito en el subíndice junto a él en la fórmula molecular. Si no hay un número al lado del segundo átomo, aparece una vez. Encuentre el prefijo griego apropiado de la tabla anterior y escríbalo a continuación. - En nuestro elemento de muestra, CF4, el flúor es el segundo elemento y aparece cuatro veces. Escribiremos el prefijo griego para cuatro, tetra, luego, así: "Tetra de carbono"
-
 3 Nombra el segundo átomo y finalízalo con "-ide"." Ahora, simplemente escriba el nombre del segundo átomo como si fuera un anión (ion cargado negativamente). En otras palabras, solo pega "-ide" al final. En la mayoría de los casos, tendrá que soltar una o dos letras al final del nombre, pero esto es algo que parecerá más natural cuanto más lo haga. Por ejemplo, el oxígeno se convierte en "óxido", el cloro se convierte en "cloruro", y así sucesivamente.[5]
3 Nombra el segundo átomo y finalízalo con "-ide"." Ahora, simplemente escriba el nombre del segundo átomo como si fuera un anión (ion cargado negativamente). En otras palabras, solo pega "-ide" al final. En la mayoría de los casos, tendrá que soltar una o dos letras al final del nombre, pero esto es algo que parecerá más natural cuanto más lo haga. Por ejemplo, el oxígeno se convierte en "óxido", el cloro se convierte en "cloruro", y así sucesivamente.[5] - En nuestro elemento de muestra, CF4, el flúor es el segundo elemento, por lo que lo escribiremos al final. Asegúrate de agregar la terminación -ide, como esta: "Tetrafluoruro de carbono".
- Observe que el prefijo griego y el segundo átomo forman una sola palabra juntos. Nunca se escriben como 2 palabras separadas.
-
 4 Agregue un prefijo griego al principio si hay más de uno del primer átomo. Determine cuántas veces aparece el primer átomo en la molécula. Si tiene la fórmula molecular, este será el número escrito en el subíndice después del primer átomo. Nuevamente, si no hay número, el primer átomo aparece una vez. Si el átomo hace aparece más de una vez, escribe su prefijo griego al comienzo del nombre.
4 Agregue un prefijo griego al principio si hay más de uno del primer átomo. Determine cuántas veces aparece el primer átomo en la molécula. Si tiene la fórmula molecular, este será el número escrito en el subíndice después del primer átomo. Nuevamente, si no hay número, el primer átomo aparece una vez. Si el átomo hace aparece más de una vez, escribe su prefijo griego al comienzo del nombre. - En nuestro elemento de muestra, CF4, el carbono aparece una vez, por lo que no tenemos que hacer nada. No escribiríamos "mono" al principio. Solo usas "mono" para el segundo átomo, nunca el primero. Por ejemplo, el tetracloruro de dinitrógeno se escribiría como N2F4.
-
 5 Ponlo todo junto. Felicitaciones, ya terminaste. El nombre de su compuesto está escrito en esta forma:
5 Ponlo todo junto. Felicitaciones, ya terminaste. El nombre de su compuesto está escrito en esta forma: - [Prefijo (si hay más de uno)] [Átomo 1] seguido de [Prefijo] [Átomo 2 "-ide"]
- Ya conocemos el nombre de nuestro compuesto: Tetrafluoruro de carbono.
-
 6 Sepa que ciertos compuestos son excepciones a las reglas de nombres normales. Las reglas anteriores le servirán bien para casi todas las moléculas covalentes binarias normales. Sin embargo, algunas moléculas selectas obtienen nombres especiales que casi siempre se utilizan cuando se discuten en entornos científicos. Realmente no hay ninguna forma de predecir esto, solo tienes que aprenderlos. Algunos ejemplos incluyen:[6]
6 Sepa que ciertos compuestos son excepciones a las reglas de nombres normales. Las reglas anteriores le servirán bien para casi todas las moléculas covalentes binarias normales. Sin embargo, algunas moléculas selectas obtienen nombres especiales que casi siempre se utilizan cuando se discuten en entornos científicos. Realmente no hay ninguna forma de predecir esto, solo tienes que aprenderlos. Algunos ejemplos incluyen:[6] - H2O no es óxido de dihidrógeno. Sus "agua."
- NUEVA HAMPSHIRE3 no es trihidruro de nitrógeno Sus "amoníaco."
- CH4 no es tetrahidruro de carbono Sus "metano."
Método tres de tres:
Nombrando Ácidos y Oxiácidos
-
 1 Compruebe si el ácido contiene un oxígeno. Los ácidos son compuestos que donan protones a reacciones químicas. A menudo, los ácidos comienzan con uno o más átomos de H, aunque hay algunas excepciones.[7] El primer paso para nombrar un ácido es fácil: primero, ver rápidamente si hay oxígeno (O) en él.
1 Compruebe si el ácido contiene un oxígeno. Los ácidos son compuestos que donan protones a reacciones químicas. A menudo, los ácidos comienzan con uno o más átomos de H, aunque hay algunas excepciones.[7] El primer paso para nombrar un ácido es fácil: primero, ver rápidamente si hay oxígeno (O) en él. - Por ejemplo, digamos que estamos trabajando con el ácido HCl. Esto obviamente hace no tener oxígeno en ella
-
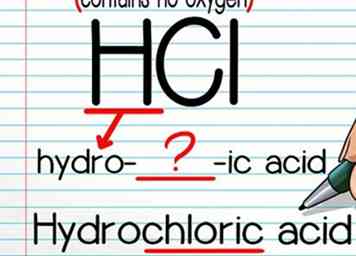 2 Use la fórmula "hydro- (name) -ic acid" si no hay un átomo de oxígeno. Nombrar ácidos sin un átomo de oxígeno es fácil. Primero, escribe "hidro-", luego el nombre del átomo que no es de hidrógeno, luego "-ic". Por lo general, tendrá que soltar una letra o dos del nombre del átomo para que la palabra "fluya" correctamente: esto suele ser bastante intuitivo. Termina con la palabra "ácido".
2 Use la fórmula "hydro- (name) -ic acid" si no hay un átomo de oxígeno. Nombrar ácidos sin un átomo de oxígeno es fácil. Primero, escribe "hidro-", luego el nombre del átomo que no es de hidrógeno, luego "-ic". Por lo general, tendrá que soltar una letra o dos del nombre del átomo para que la palabra "fluya" correctamente: esto suele ser bastante intuitivo. Termina con la palabra "ácido". - Por ejemplo, HCl se convierte "ácido clorhídrico."
- Otros ejemplos incluyen HF (ácido fluorhídrico) y HI (ácido yodhídrico).
-
 3 Nombra el anión de oxígeno primero si hay un átomo de oxígeno. Los ácidos que contienen oxígeno son un poco más difíciles de nombrar. En general, es más fácil comenzar por nombrar el anión de oxígeno (la parte de la molécula que tiene una carga negativa con el oxígeno que contiene). Por lo general, esta es la parte que es no los hidrógenos Siga los pasos a continuación para nombrar aniones de oxígeno:[8]
3 Nombra el anión de oxígeno primero si hay un átomo de oxígeno. Los ácidos que contienen oxígeno son un poco más difíciles de nombrar. En general, es más fácil comenzar por nombrar el anión de oxígeno (la parte de la molécula que tiene una carga negativa con el oxígeno que contiene). Por lo general, esta es la parte que es no los hidrógenos Siga los pasos a continuación para nombrar aniones de oxígeno:[8] -
 4 Averigua cuántos aniones hay en la misma serie que el tuyo. Los aniones están en la misma serie cuando puede agregar o quitar oxígenos y mantener la carga general igual al cambiar el estado de oxidación del catión (la parte con carga positiva del anión). Una buena guía de estados de oxidación está disponible aquí.[9]
4 Averigua cuántos aniones hay en la misma serie que el tuyo. Los aniones están en la misma serie cuando puede agregar o quitar oxígenos y mantener la carga general igual al cambiar el estado de oxidación del catión (la parte con carga positiva del anión). Una buena guía de estados de oxidación está disponible aquí.[9] - Si hay 2 aniones en la misma serie, el 1 con menos oxígenos termina con -ite y el 1 con más oxígenos termina con -ate. Por ejemplo, SO32- y entonces42- son ambos posibles dependiendo de si S tiene un estado de oxidación de 4+ o 6+. El primero es sulfito y el segundo es sulfato basado en su cantidad de oxígenos.
- Si hay más de 2 aniones en la misma serie, use el prefijo "hypo" para el 1 con menos oxígeno y el prefijo "per-" para el 1 con la mayor cantidad de oxígeno. Por ejemplo, el cloro puede formar ClO-, ClO2-, ClO3-y ClO4-. Estos son nombrados hipoclorito, clorita, cloratoy perclorato respectivamente.
-
 5 Usa el nombre del anión de oxígeno para encontrar el nombre del ácido. Ahora que ha nombrado el anión de oxígeno, encontrar el nombre del ácido en sí no es difícil. Use las siguientes reglas de denominación:
5 Usa el nombre del anión de oxígeno para encontrar el nombre del ácido. Ahora que ha nombrado el anión de oxígeno, encontrar el nombre del ácido en sí no es difícil. Use las siguientes reglas de denominación: - Si el anión termina en -ate, el ácido termina con -ric o -ic.
-
- Ejemplo: HClO2 es ácido cloroso (de "clorato", el nombre del anión de oxígeno).
-
- Si el anión termina en -ite, el ácido termina en -ous.
-
- Ejemplo: HClO3 es ácido clorhídrico (de "clorita", el nombre del anión de oxígeno).
-
- Agregue hypo- o per- al principio si el anión tenía estos prefijos.
-
- Ejemplo: HClO4 es ácido percloroso (de "perclorato", el nombre del anión de oxígeno).
-
- Si el anión termina en -ate, el ácido termina con -ric o -ic.
-
 6 Identificar excepciones de nombre ácido. Al igual que con los compuestos covalentes normales, ciertos ácidos obtienen nombres especiales que no se ajustan a las reglas de nomenclatura normales. No hay una manera fácil de aprender esto, pero son fáciles de memorizar a medida que comienzas a encontrarlos. Abajo hay algunos ejemplos:
6 Identificar excepciones de nombre ácido. Al igual que con los compuestos covalentes normales, ciertos ácidos obtienen nombres especiales que no se ajustan a las reglas de nomenclatura normales. No hay una manera fácil de aprender esto, pero son fáciles de memorizar a medida que comienzas a encontrarlos. Abajo hay algunos ejemplos: - HCN es "ácido hidrociánico". Aquí, no hay oxígeno, pero todavía obtienes el nombre del anión CN, no el nombre de ninguno de los dos átomos.
- CH3COOH es "ácido acético." Técnicamente, este compuesto se nombra con las reglas de denominación de la química orgánica, pero estos no entran en juego con los compuestos covalentes básicos.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Nombra el primer elemento en el compuesto. Las fórmulas moleculares se leen de izquierda a derecha, al igual que las palabras en inglés. Generalmente, el primer átomo (el 1 a la izquierda de la fórmula molecular) también es el átomo menos abundante en el compuesto. Escribe el nombre de este átomo primero.
1 Nombra el primer elemento en el compuesto. Las fórmulas moleculares se leen de izquierda a derecha, al igual que las palabras en inglés. Generalmente, el primer átomo (el 1 a la izquierda de la fórmula molecular) también es el átomo menos abundante en el compuesto. Escribe el nombre de este átomo primero.  2 Escribe el prefijo griego para el número del segundo átomo. Luego, mira el segundo átomo en la molécula. Determine cuántas veces aparece en la molécula. Este es el número escrito en el subíndice junto a él en la fórmula molecular. Si no hay un número al lado del segundo átomo, aparece una vez. Encuentre el prefijo griego apropiado de la tabla anterior y escríbalo a continuación.
2 Escribe el prefijo griego para el número del segundo átomo. Luego, mira el segundo átomo en la molécula. Determine cuántas veces aparece en la molécula. Este es el número escrito en el subíndice junto a él en la fórmula molecular. Si no hay un número al lado del segundo átomo, aparece una vez. Encuentre el prefijo griego apropiado de la tabla anterior y escríbalo a continuación.  3 Nombra el segundo átomo y finalízalo con "-ide"." Ahora, simplemente escriba el nombre del segundo átomo como si fuera un anión (ion cargado negativamente). En otras palabras, solo pega "-ide" al final. En la mayoría de los casos, tendrá que soltar una o dos letras al final del nombre, pero esto es algo que parecerá más natural cuanto más lo haga. Por ejemplo, el oxígeno se convierte en "óxido", el cloro se convierte en "cloruro", y así sucesivamente.[5]
3 Nombra el segundo átomo y finalízalo con "-ide"." Ahora, simplemente escriba el nombre del segundo átomo como si fuera un anión (ion cargado negativamente). En otras palabras, solo pega "-ide" al final. En la mayoría de los casos, tendrá que soltar una o dos letras al final del nombre, pero esto es algo que parecerá más natural cuanto más lo haga. Por ejemplo, el oxígeno se convierte en "óxido", el cloro se convierte en "cloruro", y así sucesivamente.[5]  4 Agregue un prefijo griego al principio si hay más de uno del primer átomo. Determine cuántas veces aparece el primer átomo en la molécula. Si tiene la fórmula molecular, este será el número escrito en el subíndice después del primer átomo. Nuevamente, si no hay número, el primer átomo aparece una vez. Si el átomo hace aparece más de una vez, escribe su prefijo griego al comienzo del nombre.
4 Agregue un prefijo griego al principio si hay más de uno del primer átomo. Determine cuántas veces aparece el primer átomo en la molécula. Si tiene la fórmula molecular, este será el número escrito en el subíndice después del primer átomo. Nuevamente, si no hay número, el primer átomo aparece una vez. Si el átomo hace aparece más de una vez, escribe su prefijo griego al comienzo del nombre.  5 Ponlo todo junto. Felicitaciones, ya terminaste. El nombre de su compuesto está escrito en esta forma:
5 Ponlo todo junto. Felicitaciones, ya terminaste. El nombre de su compuesto está escrito en esta forma:  6 Sepa que ciertos compuestos son excepciones a las reglas de nombres normales. Las reglas anteriores le servirán bien para casi todas las moléculas covalentes binarias normales. Sin embargo, algunas moléculas selectas obtienen nombres especiales que casi siempre se utilizan cuando se discuten en entornos científicos. Realmente no hay ninguna forma de predecir esto, solo tienes que aprenderlos. Algunos ejemplos incluyen:[6]
6 Sepa que ciertos compuestos son excepciones a las reglas de nombres normales. Las reglas anteriores le servirán bien para casi todas las moléculas covalentes binarias normales. Sin embargo, algunas moléculas selectas obtienen nombres especiales que casi siempre se utilizan cuando se discuten en entornos científicos. Realmente no hay ninguna forma de predecir esto, solo tienes que aprenderlos. Algunos ejemplos incluyen:[6]  1 Compruebe si el ácido contiene un oxígeno. Los ácidos son compuestos que donan protones a reacciones químicas. A menudo, los ácidos comienzan con uno o más átomos de H, aunque hay algunas excepciones.[7] El primer paso para nombrar un ácido es fácil: primero, ver rápidamente si hay oxígeno (O) en él.
1 Compruebe si el ácido contiene un oxígeno. Los ácidos son compuestos que donan protones a reacciones químicas. A menudo, los ácidos comienzan con uno o más átomos de H, aunque hay algunas excepciones.[7] El primer paso para nombrar un ácido es fácil: primero, ver rápidamente si hay oxígeno (O) en él.  2 Use la fórmula "hydro- (name) -ic acid" si no hay un átomo de oxígeno. Nombrar ácidos sin un átomo de oxígeno es fácil. Primero, escribe "hidro-", luego el nombre del átomo que no es de hidrógeno, luego "-ic". Por lo general, tendrá que soltar una letra o dos del nombre del átomo para que la palabra "fluya" correctamente: esto suele ser bastante intuitivo. Termina con la palabra "ácido".
2 Use la fórmula "hydro- (name) -ic acid" si no hay un átomo de oxígeno. Nombrar ácidos sin un átomo de oxígeno es fácil. Primero, escribe "hidro-", luego el nombre del átomo que no es de hidrógeno, luego "-ic". Por lo general, tendrá que soltar una letra o dos del nombre del átomo para que la palabra "fluya" correctamente: esto suele ser bastante intuitivo. Termina con la palabra "ácido".  3 Nombra el anión de oxígeno primero si hay un átomo de oxígeno. Los ácidos que contienen oxígeno son un poco más difíciles de nombrar. En general, es más fácil comenzar por nombrar el anión de oxígeno (la parte de la molécula que tiene una carga negativa con el oxígeno que contiene). Por lo general, esta es la parte que es no los hidrógenos Siga los pasos a continuación para nombrar aniones de oxígeno:[8]
3 Nombra el anión de oxígeno primero si hay un átomo de oxígeno. Los ácidos que contienen oxígeno son un poco más difíciles de nombrar. En general, es más fácil comenzar por nombrar el anión de oxígeno (la parte de la molécula que tiene una carga negativa con el oxígeno que contiene). Por lo general, esta es la parte que es no los hidrógenos Siga los pasos a continuación para nombrar aniones de oxígeno:[8]  4 Averigua cuántos aniones hay en la misma serie que el tuyo. Los aniones están en la misma serie cuando puede agregar o quitar oxígenos y mantener la carga general igual al cambiar el estado de oxidación del catión (la parte con carga positiva del anión). Una buena guía de estados de oxidación está disponible aquí.[9]
4 Averigua cuántos aniones hay en la misma serie que el tuyo. Los aniones están en la misma serie cuando puede agregar o quitar oxígenos y mantener la carga general igual al cambiar el estado de oxidación del catión (la parte con carga positiva del anión). Una buena guía de estados de oxidación está disponible aquí.[9]  5 Usa el nombre del anión de oxígeno para encontrar el nombre del ácido. Ahora que ha nombrado el anión de oxígeno, encontrar el nombre del ácido en sí no es difícil. Use las siguientes reglas de denominación:
5 Usa el nombre del anión de oxígeno para encontrar el nombre del ácido. Ahora que ha nombrado el anión de oxígeno, encontrar el nombre del ácido en sí no es difícil. Use las siguientes reglas de denominación:  6 Identificar excepciones de nombre ácido. Al igual que con los compuestos covalentes normales, ciertos ácidos obtienen nombres especiales que no se ajustan a las reglas de nomenclatura normales. No hay una manera fácil de aprender esto, pero son fáciles de memorizar a medida que comienzas a encontrarlos. Abajo hay algunos ejemplos:
6 Identificar excepciones de nombre ácido. Al igual que con los compuestos covalentes normales, ciertos ácidos obtienen nombres especiales que no se ajustan a las reglas de nomenclatura normales. No hay una manera fácil de aprender esto, pero son fáciles de memorizar a medida que comienzas a encontrarlos. Abajo hay algunos ejemplos: