Probablemente hayas aprendido a lo largo del camino que el agua está compuesta de oxígeno e hidrógeno. En lugar de tomar la palabra de alguien para ello, puede comprobarlo separando el agua en sus componentes. La técnica más común para separar las moléculas de agua se conoce como electrólisis. Aunque la electrólisis se puede hacer con suministros domésticos, el ácido acético (vinagre) no promueve la electrólisis lo suficiente como para generar una cantidad notable de gas. Puede probarse esto haciendo electrólisis con vinagre y luego con bicarbonato de sodio. Notarás que la electrólisis con bicarbonato de sodio produce mucho más gas que con vinagre.
Método uno de tres:
Construyendo el Aparato
-
 1 Comience con una tina vacía. Puede usar una tina de plástico o vidrio. Evite el uso de una tina de metal, ya que se ejecutará una corriente eléctrica a través del agua. El tamaño de la bañera no importa, pero un buen punto de partida sería usar un 1⁄2 envase de galón (1.9 L).[1]
1 Comience con una tina vacía. Puede usar una tina de plástico o vidrio. Evite el uso de una tina de metal, ya que se ejecutará una corriente eléctrica a través del agua. El tamaño de la bañera no importa, pero un buen punto de partida sería usar un 1⁄2 envase de galón (1.9 L).[1] -
 2 Tape los clips de cocodrilo en el fondo de la bañera. Necesitarás 2 pinzas de cocodrilo. Uno se conectará a su electrodo positivo (el ánodo) y el otro se conectará a su electrodo negativo (el cátodo). Fije con cinta adhesiva un extremo de cada clip al fondo de la bañera. Asegúrese de dejar suficiente espacio para que pueda abrir y cerrar el clip.[2]
2 Tape los clips de cocodrilo en el fondo de la bañera. Necesitarás 2 pinzas de cocodrilo. Uno se conectará a su electrodo positivo (el ánodo) y el otro se conectará a su electrodo negativo (el cátodo). Fije con cinta adhesiva un extremo de cada clip al fondo de la bañera. Asegúrese de dejar suficiente espacio para que pueda abrir y cerrar el clip.[2] -
 3 Conecte los electrodos. Necesitará 2 electrodos hechos de un material no reactivo que conduzca bien la electricidad. Una elección óptima es platino, pero si no tiene electrodos de platino, puede usar grafito. Afeita la madera con 2 lápices para hacer 2 varillas de grafito. Clip uno a cada clip de cocodrilo dentro de la bañera.
3 Conecte los electrodos. Necesitará 2 electrodos hechos de un material no reactivo que conduzca bien la electricidad. Una elección óptima es platino, pero si no tiene electrodos de platino, puede usar grafito. Afeita la madera con 2 lápices para hacer 2 varillas de grafito. Clip uno a cada clip de cocodrilo dentro de la bañera. - Las varillas de grafito son excelentes electrodos ya que no se disolverán en agua y conducirán electricidad.
Método dos de tres:
Electrolizando agua y vinagre
-
 1 Mezcle una solución de vinagre. Agregue 5 cucharadas (74 ml) de vinagre a 1⁄2 galón (1.9 L) de agua. La solución resultante será ligeramente ácida y podrá conducir una pequeña cantidad de electricidad. Vierta la solución en la bañera.[3]
1 Mezcle una solución de vinagre. Agregue 5 cucharadas (74 ml) de vinagre a 1⁄2 galón (1.9 L) de agua. La solución resultante será ligeramente ácida y podrá conducir una pequeña cantidad de electricidad. Vierta la solución en la bañera.[3] - Puede o no usar toda la solución. Solo llena la bañera la mayor parte del camino.
-
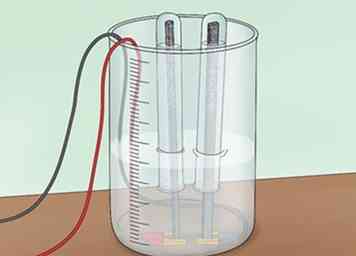 2 Invierta un tubo de prueba sobre cada electrodo. Primero, llena 2 tubos de prueba con agua. Puedes llenarlos desde el grifo o con el agua de tu bañera. Invierta cada tubo de ensayo sobre uno de los electrodos de grafito y en el agua. Asegúrese de no tener burbujas de aire en los tubos de ensayo. Estos tubos están destinados a recoger cualquier hidrógeno u oxígeno que se forme.[4]
2 Invierta un tubo de prueba sobre cada electrodo. Primero, llena 2 tubos de prueba con agua. Puedes llenarlos desde el grifo o con el agua de tu bañera. Invierta cada tubo de ensayo sobre uno de los electrodos de grafito y en el agua. Asegúrese de no tener burbujas de aire en los tubos de ensayo. Estos tubos están destinados a recoger cualquier hidrógeno u oxígeno que se forme.[4] - Deberá usar una abrazadera para sostener los tubos de prueba en su lugar sobre las varillas.
-
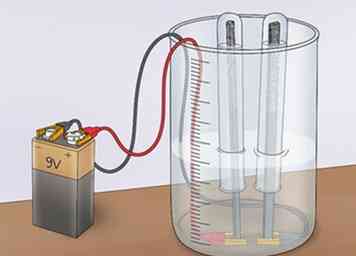 3 Conecte las pinzas de cocodrilo a una fuente de alimentación. Conecte las pinzas de cocodrilo (el lado opuesto a los electrodos) a cualquiera de los terminales de una batería de 9V. Esto completará el circuito y permitirá que la electricidad fluya. Sin embargo, la corriente estará limitada por la incapacidad de la solución de vinagre para una buena conducción. Esto confirmará que el ácido acético en el vinagre no promueve la electrólisis del agua.[5]
3 Conecte las pinzas de cocodrilo a una fuente de alimentación. Conecte las pinzas de cocodrilo (el lado opuesto a los electrodos) a cualquiera de los terminales de una batería de 9V. Esto completará el circuito y permitirá que la electricidad fluya. Sin embargo, la corriente estará limitada por la incapacidad de la solución de vinagre para una buena conducción. Esto confirmará que el ácido acético en el vinagre no promueve la electrólisis del agua.[5] - Esta limitación en la corriente prohíbe que el agua se divida en hidrógeno y oxígeno.
- El vinagre es un ácido débil, por lo que no se disocia completamente cuando se disuelve en agua, lo que significa que hay menos iones para conducir la electricidad.
Método tres de tres:
Electrolizando agua y bicarbonato de sodio
-
 1 Llene la bañera con una solución de bicarbonato de sodio. Agregue 1 cucharada (21 g) de bicarbonato de sodio (bicarbonato de sodio) a 1⁄2 galón (1.9 L) de agua. El bicarbonato de sodio se disolverá en electrolitos en la solución. Estos electrolitos aumentarán la cantidad de corriente que el agua puede conducir. [6]
1 Llene la bañera con una solución de bicarbonato de sodio. Agregue 1 cucharada (21 g) de bicarbonato de sodio (bicarbonato de sodio) a 1⁄2 galón (1.9 L) de agua. El bicarbonato de sodio se disolverá en electrolitos en la solución. Estos electrolitos aumentarán la cantidad de corriente que el agua puede conducir. [6] - El bicarbonato de sodio forma iones de sodio y bicarbonato cuando se disocia.
-
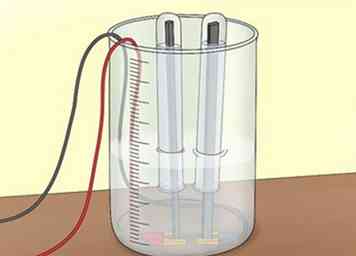 2 Cubra los electrodos. Llene 2 tubos de prueba con agua del grifo o de la bañera. Voltee cada tubo de ensayo al revés para cubrir cada electrodo. Asegúrese de no dejar que entre aire en los tubos de ensayo. Los tubos recogerán los gases que produces durante la electrólisis.[7]
2 Cubra los electrodos. Llene 2 tubos de prueba con agua del grifo o de la bañera. Voltee cada tubo de ensayo al revés para cubrir cada electrodo. Asegúrese de no dejar que entre aire en los tubos de ensayo. Los tubos recogerán los gases que produces durante la electrólisis.[7] - Use una abrazadera para sostener los tubos de prueba en su lugar sobre los electrodos.
-
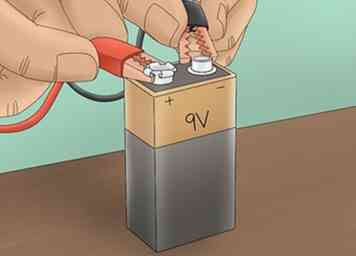 3 Conecte la fuente de poder. Conecte 1 pinza cocodrilo al terminal positivo de una batería de 9V. Conecte el otro al terminal negativo. Esto creará un circuito que permite que la corriente fluya a través de la solución de electrolito.
3 Conecte la fuente de poder. Conecte 1 pinza cocodrilo al terminal positivo de una batería de 9V. Conecte el otro al terminal negativo. Esto creará un circuito que permite que la corriente fluya a través de la solución de electrolito. -
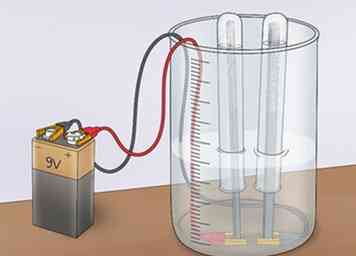 4 Observe cómo se acumulan las burbujas en el ánodo y el cátodo. A medida que la corriente fluye a través de la solución, dividirá algunas de las moléculas de agua. El resultado será hidrógeno gaseoso (H2) y oxígeno gaseoso (O2) El gas de oxígeno, que tiene una carga de -2, se verá atraído por una carga positiva y se acumulará en el ánodo (un aceptor de electrones que atrae cargas negativas, llamadas aniones). El gas de hidrógeno, que tiene una carga de +1, se verá atraído por una carga negativa y se acumulará en el cátodo (un aceptor de electrones que atrae cargas positivas, llamadas cationes).[8]
4 Observe cómo se acumulan las burbujas en el ánodo y el cátodo. A medida que la corriente fluye a través de la solución, dividirá algunas de las moléculas de agua. El resultado será hidrógeno gaseoso (H2) y oxígeno gaseoso (O2) El gas de oxígeno, que tiene una carga de -2, se verá atraído por una carga positiva y se acumulará en el ánodo (un aceptor de electrones que atrae cargas negativas, llamadas aniones). El gas de hidrógeno, que tiene una carga de +1, se verá atraído por una carga negativa y se acumulará en el cátodo (un aceptor de electrones que atrae cargas positivas, llamadas cationes).[8] - A medida que los gases se acumulan, burbujearán fuera del agua alrededor de sus respectivos electrodos y serán capturados en los tubos de ensayo.
- Notará que el agua está siendo desplazada en la parte superior del tubo de ensayo y reemplazada por los gases.
- Tenga en cuenta que el tubo que cubre el cátodo desplaza el doble de agua que el tubo que cubre el ánodo. Esto se debe a que hay dos veces más moléculas de hidrógeno que se forman como moléculas de oxígeno.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Comience con una tina vacía. Puede usar una tina de plástico o vidrio. Evite el uso de una tina de metal, ya que se ejecutará una corriente eléctrica a través del agua. El tamaño de la bañera no importa, pero un buen punto de partida sería usar un
1 Comience con una tina vacía. Puede usar una tina de plástico o vidrio. Evite el uso de una tina de metal, ya que se ejecutará una corriente eléctrica a través del agua. El tamaño de la bañera no importa, pero un buen punto de partida sería usar un  2 Tape los clips de cocodrilo en el fondo de la bañera. Necesitarás 2 pinzas de cocodrilo. Uno se conectará a su electrodo positivo (el ánodo) y el otro se conectará a su electrodo negativo (el cátodo). Fije con cinta adhesiva un extremo de cada clip al fondo de la bañera. Asegúrese de dejar suficiente espacio para que pueda abrir y cerrar el clip.[2]
2 Tape los clips de cocodrilo en el fondo de la bañera. Necesitarás 2 pinzas de cocodrilo. Uno se conectará a su electrodo positivo (el ánodo) y el otro se conectará a su electrodo negativo (el cátodo). Fije con cinta adhesiva un extremo de cada clip al fondo de la bañera. Asegúrese de dejar suficiente espacio para que pueda abrir y cerrar el clip.[2]  3 Conecte los electrodos. Necesitará 2 electrodos hechos de un material no reactivo que conduzca bien la electricidad. Una elección óptima es platino, pero si no tiene electrodos de platino, puede usar grafito. Afeita la madera con 2 lápices para hacer 2 varillas de grafito. Clip uno a cada clip de cocodrilo dentro de la bañera.
3 Conecte los electrodos. Necesitará 2 electrodos hechos de un material no reactivo que conduzca bien la electricidad. Una elección óptima es platino, pero si no tiene electrodos de platino, puede usar grafito. Afeita la madera con 2 lápices para hacer 2 varillas de grafito. Clip uno a cada clip de cocodrilo dentro de la bañera.  1 Mezcle una solución de vinagre. Agregue 5 cucharadas (74 ml) de vinagre a
1 Mezcle una solución de vinagre. Agregue 5 cucharadas (74 ml) de vinagre a  2 Invierta un tubo de prueba sobre cada electrodo. Primero, llena 2 tubos de prueba con agua. Puedes llenarlos desde el grifo o con el agua de tu bañera. Invierta cada tubo de ensayo sobre uno de los electrodos de grafito y en el agua. Asegúrese de no tener burbujas de aire en los tubos de ensayo. Estos tubos están destinados a recoger cualquier hidrógeno u oxígeno que se forme.[4]
2 Invierta un tubo de prueba sobre cada electrodo. Primero, llena 2 tubos de prueba con agua. Puedes llenarlos desde el grifo o con el agua de tu bañera. Invierta cada tubo de ensayo sobre uno de los electrodos de grafito y en el agua. Asegúrese de no tener burbujas de aire en los tubos de ensayo. Estos tubos están destinados a recoger cualquier hidrógeno u oxígeno que se forme.[4]  3 Conecte las pinzas de cocodrilo a una fuente de alimentación. Conecte las pinzas de cocodrilo (el lado opuesto a los electrodos) a cualquiera de los terminales de una batería de 9V. Esto completará el circuito y permitirá que la electricidad fluya. Sin embargo, la corriente estará limitada por la incapacidad de la solución de vinagre para una buena conducción. Esto confirmará que el ácido acético en el vinagre no promueve la electrólisis del agua.[5]
3 Conecte las pinzas de cocodrilo a una fuente de alimentación. Conecte las pinzas de cocodrilo (el lado opuesto a los electrodos) a cualquiera de los terminales de una batería de 9V. Esto completará el circuito y permitirá que la electricidad fluya. Sin embargo, la corriente estará limitada por la incapacidad de la solución de vinagre para una buena conducción. Esto confirmará que el ácido acético en el vinagre no promueve la electrólisis del agua.[5]  1 Llene la bañera con una solución de bicarbonato de sodio. Agregue 1 cucharada (21 g) de bicarbonato de sodio (bicarbonato de sodio) a
1 Llene la bañera con una solución de bicarbonato de sodio. Agregue 1 cucharada (21 g) de bicarbonato de sodio (bicarbonato de sodio) a  2 Cubra los electrodos. Llene 2 tubos de prueba con agua del grifo o de la bañera. Voltee cada tubo de ensayo al revés para cubrir cada electrodo. Asegúrese de no dejar que entre aire en los tubos de ensayo. Los tubos recogerán los gases que produces durante la electrólisis.[7]
2 Cubra los electrodos. Llene 2 tubos de prueba con agua del grifo o de la bañera. Voltee cada tubo de ensayo al revés para cubrir cada electrodo. Asegúrese de no dejar que entre aire en los tubos de ensayo. Los tubos recogerán los gases que produces durante la electrólisis.[7]  3 Conecte la fuente de poder. Conecte 1 pinza cocodrilo al terminal positivo de una batería de 9V. Conecte el otro al terminal negativo. Esto creará un circuito que permite que la corriente fluya a través de la solución de electrolito.
3 Conecte la fuente de poder. Conecte 1 pinza cocodrilo al terminal positivo de una batería de 9V. Conecte el otro al terminal negativo. Esto creará un circuito que permite que la corriente fluya a través de la solución de electrolito.  4 Observe cómo se acumulan las burbujas en el ánodo y el cátodo. A medida que la corriente fluye a través de la solución, dividirá algunas de las moléculas de agua. El resultado será hidrógeno gaseoso (H2) y oxígeno gaseoso (O2) El gas de oxígeno, que tiene una carga de -2, se verá atraído por una carga positiva y se acumulará en el ánodo (un aceptor de electrones que atrae cargas negativas, llamadas aniones). El gas de hidrógeno, que tiene una carga de +1, se verá atraído por una carga negativa y se acumulará en el cátodo (un aceptor de electrones que atrae cargas positivas, llamadas cationes).[8]
4 Observe cómo se acumulan las burbujas en el ánodo y el cátodo. A medida que la corriente fluye a través de la solución, dividirá algunas de las moléculas de agua. El resultado será hidrógeno gaseoso (H2) y oxígeno gaseoso (O2) El gas de oxígeno, que tiene una carga de -2, se verá atraído por una carga positiva y se acumulará en el ánodo (un aceptor de electrones que atrae cargas negativas, llamadas aniones). El gas de hidrógeno, que tiene una carga de +1, se verá atraído por una carga negativa y se acumulará en el cátodo (un aceptor de electrones que atrae cargas positivas, llamadas cationes).[8]