En una reacción química, la materia no puede ser creada ni destruida de acuerdo con la Ley de Conservación de la Misa, por lo que los productos que salen de una reacción deben ser iguales a los reactivos que entran en reacción. Esto significa que la misma cantidad de cada átomo que ingresas debe volver a salir. La estequiometría es la medida de los elementos dentro de una reacción.[1] Implica cálculos que tienen en cuenta las masas de reactivos y productos en una reacción química determinada. La estequiometría es una mitad matemática, una mitad química, y gira en torno al simple principio anterior: el principio de que la materia nunca se pierde o gana durante una reacción. El primer paso para resolver cualquier problema químico es equilibrar la ecuación.
Parte uno de cuatro:
Equilibrando la ecuación química
-
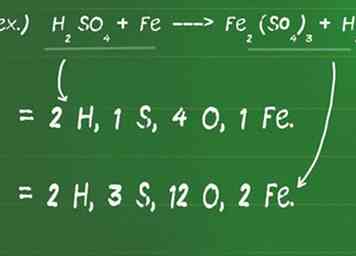 1 Anote la cantidad de átomos que componen cada compuesto en cada lado de la ecuación. Usando la ecuación química, puedes identificar los átomos de cada elemento en la reacción. Debido a que una reacción química nunca puede crear o destruir nueva materia, una ecuación dada está desequilibrada si el número (y los tipos) de átomos en cada lado de la ecuación no concuerdan perfectamente.
1 Anote la cantidad de átomos que componen cada compuesto en cada lado de la ecuación. Usando la ecuación química, puedes identificar los átomos de cada elemento en la reacción. Debido a que una reacción química nunca puede crear o destruir nueva materia, una ecuación dada está desequilibrada si el número (y los tipos) de átomos en cada lado de la ecuación no concuerdan perfectamente. - No te olvides de multiplicar por un coeficiente o subíndice si hay uno presente.
- Por ejemplo, H2ASI QUE4 + Fe ---> Fe2(ASI QUE4)3 + H2
- En el lado del reactivo (izquierda) de la ecuación hay 2 átomos de H (H2), 1 átomo S, 4 átomos O (O4) y 1 átomo de Fe.
- En el lado del producto (derecha) de la ecuación hay 2H átomos (H2), 3 átomos S (S)3), 12 átomos de O (O 12), y 2 átomos de Fe (Fe2).
-
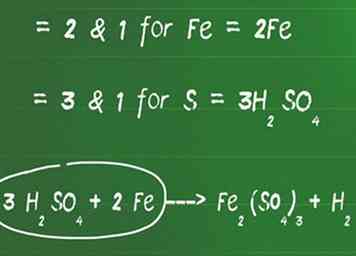 2 Agregue un coeficiente delante de elementos que no sean oxígeno e hidrógeno para equilibrar cada lado. Identifica el factor común más bajo entre todos los elementos que no son oxígeno e hidrógeno (los equilibrarás a continuación) para obtener la misma cantidad de átomos en ambos lados.
2 Agregue un coeficiente delante de elementos que no sean oxígeno e hidrógeno para equilibrar cada lado. Identifica el factor común más bajo entre todos los elementos que no son oxígeno e hidrógeno (los equilibrarás a continuación) para obtener la misma cantidad de átomos en ambos lados. - Por ejemplo, el factor común más bajo entre 2 y 1 es 2 para Fe. Agregue un 2 en frente del Fe en el lado izquierdo para equilibrarlo.
- El factor común más bajo entre 3 y 1 es 3 para S. Agregue un 3 en frente de H2ASI QUE4 para equilibrar los lados izquierdo y derecho.
- En esta etapa, nuestra ecuación se ve así: 3 H2ASI QUE4 + 2 Fe ---> Fe2(ASI QUE4)3 + H2
-
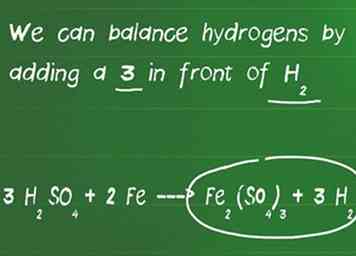 3 Equilibra los átomos de hidrógeno y oxígeno. Los átomos de hidrógeno y oxígeno están balanceados al final porque comúnmente aparecen en múltiples moléculas en cada lado de la ecuación. En esta etapa, al equilibrar la ecuación, no olvide contar los átomos si ha agregado coeficientes a las moléculas.
3 Equilibra los átomos de hidrógeno y oxígeno. Los átomos de hidrógeno y oxígeno están balanceados al final porque comúnmente aparecen en múltiples moléculas en cada lado de la ecuación. En esta etapa, al equilibrar la ecuación, no olvide contar los átomos si ha agregado coeficientes a las moléculas. - En nuestro ejemplo, agregamos un 3 en frente de H2ASI QUE4 y ahora tiene 6 hidrógenos a la izquierda y solo 2 en el lado derecho de la ecuación. También tenemos 12 de oxígeno a la izquierda y 12 de oxígeno a la derecha, por lo que está equilibrado.
- Podemos equilibrar hidrógenos agregando un 3 en frente de H2.
- Nuestra ecuación balanceada final es 3 H2ASI QUE4 + 2 Fe ---> Fe2(ASI QUE4)3 + 3 H2.
-
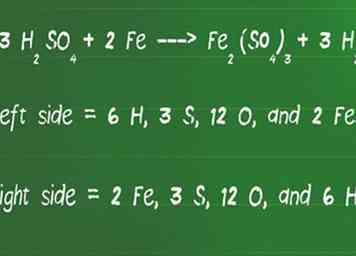 4 Vuelve a contar el número de átomos en cada lado de la ecuación para asegurarte de que son iguales. Una vez que haya terminado, es inteligente retroceder y verificar la ecuación para mantener el equilibrio. Esto se puede hacer volviendo a sumar todos los átomos de cada lado de la ecuación para asegurarse de que sean iguales en ambos lados.
4 Vuelve a contar el número de átomos en cada lado de la ecuación para asegurarte de que son iguales. Una vez que haya terminado, es inteligente retroceder y verificar la ecuación para mantener el equilibrio. Esto se puede hacer volviendo a sumar todos los átomos de cada lado de la ecuación para asegurarse de que sean iguales en ambos lados. - Revisemos nuestra ecuación, 3 H2ASI QUE4 + 2 Fe ---> Fe2(ASI QUE4)3 + 3 H2para el equilibrio
- En el lado izquierdo de la flecha, hay 6 H, 3 S, 12 O y 2 Fe.
- En el lado derecho de la flecha, hay 2 Fe, 3 S, 12 O y 6 H.
- Los lados izquierdo y derecho de la ecuación coinciden, por lo tanto, ahora está equilibrado.
Parte dos de cuatro:
Convertir entre gramos y lunares
-
 1 Calcule la masa molar del compuesto en gramos. La masa molar es la cantidad en gramos (g) de una mol de un compuesto.[2] Le permite convertir fácilmente entre gramos y moles de una sustancia.[3] Para calcular la masa molar, necesita identificar cuántas moléculas de un elemento se encuentran en el compuesto y la masa atómica de cada elemento en el compuesto.
1 Calcule la masa molar del compuesto en gramos. La masa molar es la cantidad en gramos (g) de una mol de un compuesto.[2] Le permite convertir fácilmente entre gramos y moles de una sustancia.[3] Para calcular la masa molar, necesita identificar cuántas moléculas de un elemento se encuentran en el compuesto y la masa atómica de cada elemento en el compuesto. - Defina la cantidad de átomos de cada elemento en un compuesto. Por ejemplo, la glucosa es C6H12O6, hay 6 átomos de carbono, 12 átomos de hidrógeno y 6 átomos de oxígeno.
- Identifica la masa atómica en gramos por mol (g / mol) de cada átomo. Las masas atómicas de cada elemento generalmente se encuentran debajo del símbolo del elemento en una tabla periódica, generalmente como un decimal. Las masas atómicas de los elementos en glucosa son: carbono, 12.0107 g / mol; hidrógeno, 1,007 g / mol; y oxígeno, 15.9994 g / mol.
- Multiplique la masa atómica de cada elemento por la cantidad de átomos presentes en el compuesto. Carbono: 12.0107 x 6 = 72.0642 g / mol; Hidrógeno: 1.007 x 12 = 12.084 g / mol; Oxígeno: 15.9994 x 6 = 95.9964 g / mol.
- Al agregar estos productos juntos, se obtiene la masa molar del compuesto. 72.0642 + 12.084 + 95.9964 = 180.1446 g / mol. 180.14 gramos es la masa de un mol de glucosa.
-
 2 Convierte gramos de una sustancia a moles usando masa molar. Utilizando la masa molar como factor de conversión, puede calcular la cantidad de moles presentes en el número indicado de gramos de la especie. Divida la cantidad conocida de gramos (g) por la masa molar (g / mol).[4][5] Una manera fácil de verificar que hayas hecho la matemática correcta es asegurarte de que las unidades se cancelen dejando solo topos.
2 Convierte gramos de una sustancia a moles usando masa molar. Utilizando la masa molar como factor de conversión, puede calcular la cantidad de moles presentes en el número indicado de gramos de la especie. Divida la cantidad conocida de gramos (g) por la masa molar (g / mol).[4][5] Una manera fácil de verificar que hayas hecho la matemática correcta es asegurarte de que las unidades se cancelen dejando solo topos. - Por ejemplo: ¿Cuántos moles hay en 8.2 gramos de cloruro de hidrógeno (HCl)?
- La masa atómica de H es 1.007 y Cl es 35.453 haciendo la masa molar del compuesto 1.007 + 35.453 = 36.46 g / mol.
- Dividiendo el número de gramos de la sustancia por los rendimientos de masa molar: 8,2 g / (36,46 g / mol) = 0,225 moles de HCl.
-
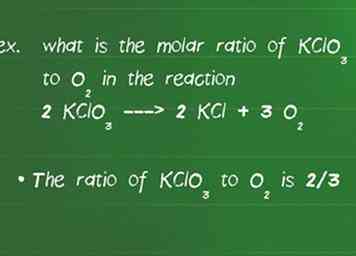 3 Determine la relación molar entre los reactivos. Para determinar el rendimiento de un producto en una reacción dada, debe determinar la relación molar.La relación molar te dice la razón por la cual las sustancias reaccionan entre sí y está dada por el coeficiente de la especie en la reacción balanceada.[6]
3 Determine la relación molar entre los reactivos. Para determinar el rendimiento de un producto en una reacción dada, debe determinar la relación molar.La relación molar te dice la razón por la cual las sustancias reaccionan entre sí y está dada por el coeficiente de la especie en la reacción balanceada.[6] - Por ejemplo, ¿cuál es la relación molar de KClO3 también2 en la reacción 2 KClO3 ---> 2 KCl + 3 O2.
- Primero, verifica que la ecuación esté equilibrada. Nunca olvide este paso o sus proporciones serán incorrectas. En este caso, hay cantidades iguales de cada elemento en ambos lados de la reacción, por lo que está equilibrado.
- La proporción de KClO3 también2 es 2/3. No importa qué número vaya arriba o abajo siempre y cuando mantenga los mismos compuestos en la parte superior e inferior durante el resto del problema.[7]
-
 4 Multiplicación cruzada por la relación molar para encontrar moles de otro reactivo. Para calcular la cantidad de moles de una especie producida o requerida para una reacción, usará la relación molar.[8] Por lo general, los problemas le pedirán que determine la cantidad de moles requeridas o la cantidad de moles producidas en una reacción dado un cierto número de gramos de reactivo.
4 Multiplicación cruzada por la relación molar para encontrar moles de otro reactivo. Para calcular la cantidad de moles de una especie producida o requerida para una reacción, usará la relación molar.[8] Por lo general, los problemas le pedirán que determine la cantidad de moles requeridas o la cantidad de moles producidas en una reacción dado un cierto número de gramos de reactivo. - Por ejemplo, dada la reacción N2 + 3 H2 ---> 2 NH3 cuantos moles de NH3 se producirá dado 3.00 gramos de N2 reaccionando con suficiente H2?
- En este ejemplo, suficiente H2 significa que hay suficiente disponible y no es necesario tenerlo en cuenta para resolver el problema.
- Primero, convierte los gramos de N2 a topos La masa atómica de nitrógeno es 14.0067 g / mol, por lo que la masa molar de N2 es 28.0134 g / mol. Dividir la masa por masa molar te da 3.00 g / 28.0134 g / mol = 0.107 mol.
- Configure los índices dados por la pregunta: NH3: N2 = x / 0,107 mol.
- Cruce multiplique esta relación por la relación molar de NH3 a N2: 2: 1. x / 0,107 mol = 2/1 = (2 x 0,107) = 1x = 0,214 mol.
-
 5 Convierta los moles a masa utilizando la masa molar de la especie. Usará la masa molar nuevamente, pero esta vez se multiplicará para convertir los moles en gramos. Asegúrese de usar la masa molar de la especie correcta.
5 Convierta los moles a masa utilizando la masa molar de la especie. Usará la masa molar nuevamente, pero esta vez se multiplicará para convertir los moles en gramos. Asegúrese de usar la masa molar de la especie correcta. - La masa molar de NH3 es 17,028 g / mol. Por lo tanto, 0.214 mol x (17.028 gramos / mol) = 3.647 gramos de NH3.
Parte tres de cuatro:
Conversión entre litros de gas y lunares
-
 1 Determine si la reacción está sucediendo a temperatura y presión estándar (STP). STP es el conjunto de condiciones dadas donde 1 mol de un gas ideal ocupará 22,414 litros (L) de volumen.[9] La temperatura estándar es 273.15 Kelvin (K) y la presión estándar es de 1 atmósfera (atm).[10]
1 Determine si la reacción está sucediendo a temperatura y presión estándar (STP). STP es el conjunto de condiciones dadas donde 1 mol de un gas ideal ocupará 22,414 litros (L) de volumen.[9] La temperatura estándar es 273.15 Kelvin (K) y la presión estándar es de 1 atmósfera (atm).[10] - Generalmente, una reacción dirá que se da a 1 atm y 273 K o simplemente dirá STP.
-
 2 Use el factor de conversión 22.414 L / mol para convertir litros de gas en moles. Si su reacción ocurre en STP, puede usar 22.414 L / mol para calcular la cantidad de moles en un volumen dado de gas.[11] Divida el volumen de gas (L) por el factor de conversión para determinar los moles.
2 Use el factor de conversión 22.414 L / mol para convertir litros de gas en moles. Si su reacción ocurre en STP, puede usar 22.414 L / mol para calcular la cantidad de moles en un volumen dado de gas.[11] Divida el volumen de gas (L) por el factor de conversión para determinar los moles. - Por ejemplo, convierta 3.2 litros de N2 gas a topos: 3,2 L / 22,414 L / mol = 0,143 moles.
-
 3 Use la ley de los gases ideales para convertir litros de gas que no estén en STP. Si le dan una reacción que no ocurre en STP, tendrá que usar la ley de gas ideal PV = nRT para determinar el número de moles en la reacción.[12] P es presión en atmósferas, V es volumen en litros, n es el número de moles, R es la ley de gas constante 0.0821 L-atm / mol-grado, y T es la temperatura en grados Kelvin.[13]
3 Use la ley de los gases ideales para convertir litros de gas que no estén en STP. Si le dan una reacción que no ocurre en STP, tendrá que usar la ley de gas ideal PV = nRT para determinar el número de moles en la reacción.[12] P es presión en atmósferas, V es volumen en litros, n es el número de moles, R es la ley de gas constante 0.0821 L-atm / mol-grado, y T es la temperatura en grados Kelvin.[13] - La ecuación puede reordenarse para resolver los moles: n = RT / PV.
- Las unidades de la constante de gas están diseñadas para cancelar las unidades de las otras variables.
- Por ejemplo, determine la cantidad de moles en 2.4 litros de O2 a 300 K y 1.5 atm. Enchufar los rendimientos de las variables: n = (0.0821 x 300) / (1.5 x 2) = 24.63 / 3.6 = 6.842 moles de O2
Parte cuatro de cuatro:
Conversión entre litros de líquido y lunares
-
 1 Calcule la densidad del líquido. Algunas veces las ecuaciones químicas le darán el volumen de un reactivo líquido y requerirán la cantidad de gramos o moles necesarios para la reacción. Para convertir a gramos, usará la densidad de ese líquido. La densidad viene dada por masa / volumen.[14]
1 Calcule la densidad del líquido. Algunas veces las ecuaciones químicas le darán el volumen de un reactivo líquido y requerirán la cantidad de gramos o moles necesarios para la reacción. Para convertir a gramos, usará la densidad de ese líquido. La densidad viene dada por masa / volumen.[14] - Si la densidad no está incluida en el problema, es posible que deba buscarla en un texto de referencia o en línea.
-
 2 Convierta el volumen a mililitros (mL). Para convertir el volumen de líquido en masa (g) necesitará usar la densidad de ese líquido. La densidad se da en gramos por mililitro (g / ml), por lo tanto, el volumen del líquido debe ser en mililitros para convertir.
2 Convierta el volumen a mililitros (mL). Para convertir el volumen de líquido en masa (g) necesitará usar la densidad de ese líquido. La densidad se da en gramos por mililitro (g / ml), por lo tanto, el volumen del líquido debe ser en mililitros para convertir. - Identifica el volumen dado. Por ejemplo, supongamos que el problema indica que tiene 1 litro de H2O. Para convertir a mL simplemente multiplique por 1000. Hay 1000 mililitros en un litro de agua.
-
 3 Multiplique el volumen por la densidad. Cuando multiplicas un volumen (ml) por la densidad de ese líquido (g / ml), los mililitros se cancelan y te quedan gramos de la sustancia.[15]
3 Multiplique el volumen por la densidad. Cuando multiplicas un volumen (ml) por la densidad de ese líquido (g / ml), los mililitros se cancelan y te quedan gramos de la sustancia.[15] - La densidad de H2O, por ejemplo, es aproximadamente 1.0 g / mL.[16]
-
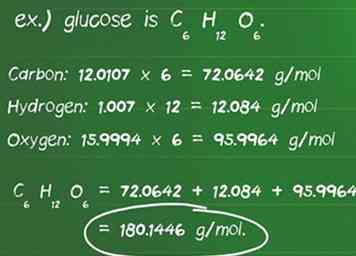 4 Calcule la masa molar del reactivo. La masa molar es la cantidad en gramos (g) de una mol de un compuesto. Le permite convertir fácilmente entre gramos y moles de una sustancia. Para calcular la masa molar, necesita identificar cuántas moléculas de un elemento se encuentran en un compuesto y la masa atómica de cada elemento en el compuesto.
4 Calcule la masa molar del reactivo. La masa molar es la cantidad en gramos (g) de una mol de un compuesto. Le permite convertir fácilmente entre gramos y moles de una sustancia. Para calcular la masa molar, necesita identificar cuántas moléculas de un elemento se encuentran en un compuesto y la masa atómica de cada elemento en el compuesto. - Defina la cantidad de átomos de cada elemento en un compuesto. Por ejemplo, la glucosa es C6H12O6, hay 6 átomos de carbono, 12 átomos de hidrógeno y 6 átomos de oxígeno.
- Identifica la masa atómica en gramos por mol (g / mol) de cada átomo. Las masas atómicas de los elementos en glucosa son: carbono, 12.0107 g / mol; hidrógeno, 1,007 g / mol; y oxígeno, 15.9994 g / mol.
- Multiplique la masa atómica de cada elemento por el número de átomos presentes en el compuesto.Carbono: 12.0107 x 6 = 72.0642 g / mol; Hidrógeno: 1.007 x 12 = 12.084 g / mol; Oxígeno: 15.9994 x 6 = 95.9964 g / mol.
- Al agregar estos productos juntos, se obtiene la masa molar del compuesto. 72.0642 + 12.084 + 95.9964 = 180.1446 g / mol. 180.14 gramos es la masa de un mol de glucosa.
-
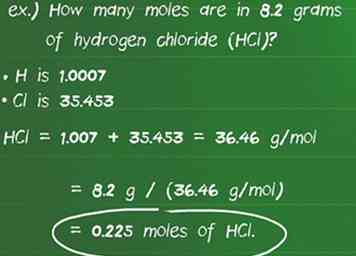 5 Convierte gramos de una sustancia a moles usando masa molar. Utilizando la masa molar como factor de conversión, puede calcular la cantidad de moles presentes en el número indicado de gramos de la especie. Divida la cantidad conocida de gramos (g) por la masa molar (g / mol).[17][18] Una manera fácil de verificar que hayas hecho la matemática correcta es asegurarte de que las unidades se cancelen dejando solo topos.
5 Convierte gramos de una sustancia a moles usando masa molar. Utilizando la masa molar como factor de conversión, puede calcular la cantidad de moles presentes en el número indicado de gramos de la especie. Divida la cantidad conocida de gramos (g) por la masa molar (g / mol).[17][18] Una manera fácil de verificar que hayas hecho la matemática correcta es asegurarte de que las unidades se cancelen dejando solo topos. - Por ejemplo: ¿Cuántos moles hay en 8.2 gramos de cloruro de hidrógeno (HCl)?
- La masa atómica de H es 1.007 y Cl es 35.453 haciendo la masa molar del compuesto 1.007 + 35.453 = 36.46 g / mol.
- Dividiendo el número de gramos de la sustancia por los rendimientos de masa molar: 8,2 g / (36,46 g / mol) = 0,225 moles de HCl.
 Minotauromaquia
Minotauromaquia
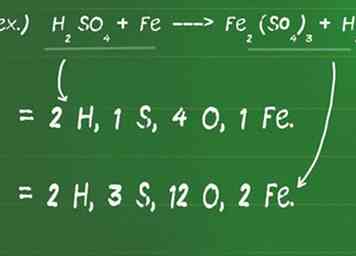 1 Anote la cantidad de átomos que componen cada compuesto en cada lado de la ecuación. Usando la ecuación química, puedes identificar los átomos de cada elemento en la reacción. Debido a que una reacción química nunca puede crear o destruir nueva materia, una ecuación dada está desequilibrada si el número (y los tipos) de átomos en cada lado de la ecuación no concuerdan perfectamente.
1 Anote la cantidad de átomos que componen cada compuesto en cada lado de la ecuación. Usando la ecuación química, puedes identificar los átomos de cada elemento en la reacción. Debido a que una reacción química nunca puede crear o destruir nueva materia, una ecuación dada está desequilibrada si el número (y los tipos) de átomos en cada lado de la ecuación no concuerdan perfectamente. 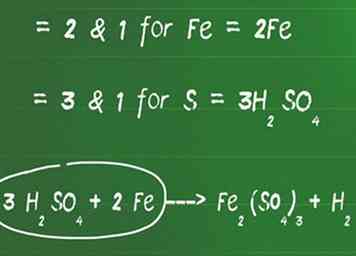 2 Agregue un coeficiente delante de elementos que no sean oxígeno e hidrógeno para equilibrar cada lado. Identifica el factor común más bajo entre todos los elementos que no son oxígeno e hidrógeno (los equilibrarás a continuación) para obtener la misma cantidad de átomos en ambos lados.
2 Agregue un coeficiente delante de elementos que no sean oxígeno e hidrógeno para equilibrar cada lado. Identifica el factor común más bajo entre todos los elementos que no son oxígeno e hidrógeno (los equilibrarás a continuación) para obtener la misma cantidad de átomos en ambos lados. 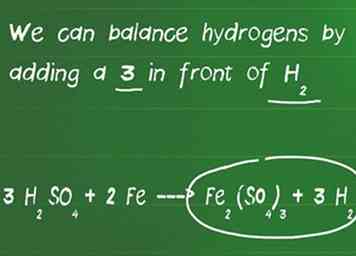 3 Equilibra los átomos de hidrógeno y oxígeno. Los átomos de hidrógeno y oxígeno están balanceados al final porque comúnmente aparecen en múltiples moléculas en cada lado de la ecuación. En esta etapa, al equilibrar la ecuación, no olvide contar los átomos si ha agregado coeficientes a las moléculas.
3 Equilibra los átomos de hidrógeno y oxígeno. Los átomos de hidrógeno y oxígeno están balanceados al final porque comúnmente aparecen en múltiples moléculas en cada lado de la ecuación. En esta etapa, al equilibrar la ecuación, no olvide contar los átomos si ha agregado coeficientes a las moléculas. 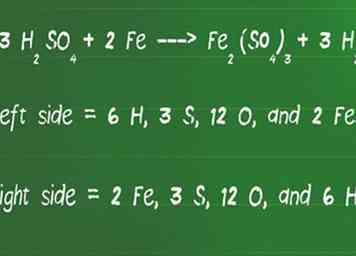 4 Vuelve a contar el número de átomos en cada lado de la ecuación para asegurarte de que son iguales. Una vez que haya terminado, es inteligente retroceder y verificar la ecuación para mantener el equilibrio. Esto se puede hacer volviendo a sumar todos los átomos de cada lado de la ecuación para asegurarse de que sean iguales en ambos lados.
4 Vuelve a contar el número de átomos en cada lado de la ecuación para asegurarte de que son iguales. Una vez que haya terminado, es inteligente retroceder y verificar la ecuación para mantener el equilibrio. Esto se puede hacer volviendo a sumar todos los átomos de cada lado de la ecuación para asegurarse de que sean iguales en ambos lados.  1 Calcule la masa molar del compuesto en gramos. La masa molar es la cantidad en gramos (g) de una mol de un compuesto.[2] Le permite convertir fácilmente entre gramos y moles de una sustancia.[3] Para calcular la masa molar, necesita identificar cuántas moléculas de un elemento se encuentran en el compuesto y la masa atómica de cada elemento en el compuesto.
1 Calcule la masa molar del compuesto en gramos. La masa molar es la cantidad en gramos (g) de una mol de un compuesto.[2] Le permite convertir fácilmente entre gramos y moles de una sustancia.[3] Para calcular la masa molar, necesita identificar cuántas moléculas de un elemento se encuentran en el compuesto y la masa atómica de cada elemento en el compuesto.  2 Convierte gramos de una sustancia a moles usando masa molar. Utilizando la masa molar como factor de conversión, puede calcular la cantidad de moles presentes en el número indicado de gramos de la especie. Divida la cantidad conocida de gramos (g) por la masa molar (g / mol).[4][5] Una manera fácil de verificar que hayas hecho la matemática correcta es asegurarte de que las unidades se cancelen dejando solo topos.
2 Convierte gramos de una sustancia a moles usando masa molar. Utilizando la masa molar como factor de conversión, puede calcular la cantidad de moles presentes en el número indicado de gramos de la especie. Divida la cantidad conocida de gramos (g) por la masa molar (g / mol).[4][5] Una manera fácil de verificar que hayas hecho la matemática correcta es asegurarte de que las unidades se cancelen dejando solo topos. 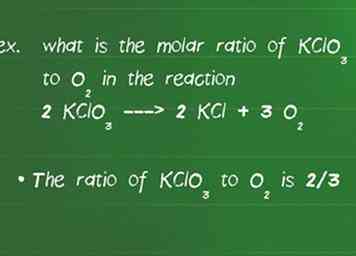 3 Determine la relación molar entre los reactivos. Para determinar el rendimiento de un producto en una reacción dada, debe determinar la relación molar.La relación molar te dice la razón por la cual las sustancias reaccionan entre sí y está dada por el coeficiente de la especie en la reacción balanceada.[6]
3 Determine la relación molar entre los reactivos. Para determinar el rendimiento de un producto en una reacción dada, debe determinar la relación molar.La relación molar te dice la razón por la cual las sustancias reaccionan entre sí y está dada por el coeficiente de la especie en la reacción balanceada.[6]  4 Multiplicación cruzada por la relación molar para encontrar moles de otro reactivo. Para calcular la cantidad de moles de una especie producida o requerida para una reacción, usará la relación molar.[8] Por lo general, los problemas le pedirán que determine la cantidad de moles requeridas o la cantidad de moles producidas en una reacción dado un cierto número de gramos de reactivo.
4 Multiplicación cruzada por la relación molar para encontrar moles de otro reactivo. Para calcular la cantidad de moles de una especie producida o requerida para una reacción, usará la relación molar.[8] Por lo general, los problemas le pedirán que determine la cantidad de moles requeridas o la cantidad de moles producidas en una reacción dado un cierto número de gramos de reactivo.  5 Convierta los moles a masa utilizando la masa molar de la especie. Usará la masa molar nuevamente, pero esta vez se multiplicará para convertir los moles en gramos. Asegúrese de usar la masa molar de la especie correcta.
5 Convierta los moles a masa utilizando la masa molar de la especie. Usará la masa molar nuevamente, pero esta vez se multiplicará para convertir los moles en gramos. Asegúrese de usar la masa molar de la especie correcta.  1 Determine si la reacción está sucediendo a temperatura y presión estándar (STP). STP es el conjunto de condiciones dadas donde 1 mol de un gas ideal ocupará 22,414 litros (L) de volumen.[9] La temperatura estándar es 273.15 Kelvin (K) y la presión estándar es de 1 atmósfera (atm).[10]
1 Determine si la reacción está sucediendo a temperatura y presión estándar (STP). STP es el conjunto de condiciones dadas donde 1 mol de un gas ideal ocupará 22,414 litros (L) de volumen.[9] La temperatura estándar es 273.15 Kelvin (K) y la presión estándar es de 1 atmósfera (atm).[10]  2 Use el factor de conversión 22.414 L / mol para convertir litros de gas en moles. Si su reacción ocurre en STP, puede usar 22.414 L / mol para calcular la cantidad de moles en un volumen dado de gas.[11] Divida el volumen de gas (L) por el factor de conversión para determinar los moles.
2 Use el factor de conversión 22.414 L / mol para convertir litros de gas en moles. Si su reacción ocurre en STP, puede usar 22.414 L / mol para calcular la cantidad de moles en un volumen dado de gas.[11] Divida el volumen de gas (L) por el factor de conversión para determinar los moles.  3 Use la ley de los gases ideales para convertir litros de gas que no estén en STP. Si le dan una reacción que no ocurre en STP, tendrá que usar la ley de gas ideal PV = nRT para determinar el número de moles en la reacción.[12] P es presión en atmósferas, V es volumen en litros, n es el número de moles, R es la ley de gas constante 0.0821 L-atm / mol-grado, y T es la temperatura en grados Kelvin.[13]
3 Use la ley de los gases ideales para convertir litros de gas que no estén en STP. Si le dan una reacción que no ocurre en STP, tendrá que usar la ley de gas ideal PV = nRT para determinar el número de moles en la reacción.[12] P es presión en atmósferas, V es volumen en litros, n es el número de moles, R es la ley de gas constante 0.0821 L-atm / mol-grado, y T es la temperatura en grados Kelvin.[13]  1 Calcule la densidad del líquido. Algunas veces las ecuaciones químicas le darán el volumen de un reactivo líquido y requerirán la cantidad de gramos o moles necesarios para la reacción. Para convertir a gramos, usará la densidad de ese líquido. La densidad viene dada por masa / volumen.[14]
1 Calcule la densidad del líquido. Algunas veces las ecuaciones químicas le darán el volumen de un reactivo líquido y requerirán la cantidad de gramos o moles necesarios para la reacción. Para convertir a gramos, usará la densidad de ese líquido. La densidad viene dada por masa / volumen.[14]  2 Convierta el volumen a mililitros (mL). Para convertir el volumen de líquido en masa (g) necesitará usar la densidad de ese líquido. La densidad se da en gramos por mililitro (g / ml), por lo tanto, el volumen del líquido debe ser en mililitros para convertir.
2 Convierta el volumen a mililitros (mL). Para convertir el volumen de líquido en masa (g) necesitará usar la densidad de ese líquido. La densidad se da en gramos por mililitro (g / ml), por lo tanto, el volumen del líquido debe ser en mililitros para convertir.  3 Multiplique el volumen por la densidad. Cuando multiplicas un volumen (ml) por la densidad de ese líquido (g / ml), los mililitros se cancelan y te quedan gramos de la sustancia.[15]
3 Multiplique el volumen por la densidad. Cuando multiplicas un volumen (ml) por la densidad de ese líquido (g / ml), los mililitros se cancelan y te quedan gramos de la sustancia.[15] 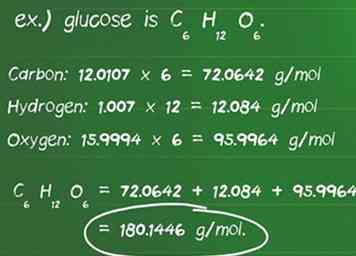 4 Calcule la masa molar del reactivo. La masa molar es la cantidad en gramos (g) de una mol de un compuesto. Le permite convertir fácilmente entre gramos y moles de una sustancia. Para calcular la masa molar, necesita identificar cuántas moléculas de un elemento se encuentran en un compuesto y la masa atómica de cada elemento en el compuesto.
4 Calcule la masa molar del reactivo. La masa molar es la cantidad en gramos (g) de una mol de un compuesto. Le permite convertir fácilmente entre gramos y moles de una sustancia. Para calcular la masa molar, necesita identificar cuántas moléculas de un elemento se encuentran en un compuesto y la masa atómica de cada elemento en el compuesto. 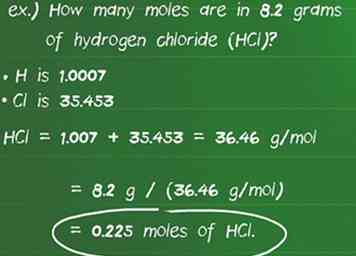 5 Convierte gramos de una sustancia a moles usando masa molar. Utilizando la masa molar como factor de conversión, puede calcular la cantidad de moles presentes en el número indicado de gramos de la especie. Divida la cantidad conocida de gramos (g) por la masa molar (g / mol).[17][18] Una manera fácil de verificar que hayas hecho la matemática correcta es asegurarte de que las unidades se cancelen dejando solo topos.
5 Convierte gramos de una sustancia a moles usando masa molar. Utilizando la masa molar como factor de conversión, puede calcular la cantidad de moles presentes en el número indicado de gramos de la especie. Divida la cantidad conocida de gramos (g) por la masa molar (g / mol).[17][18] Una manera fácil de verificar que hayas hecho la matemática correcta es asegurarte de que las unidades se cancelen dejando solo topos.