El número atómico de un elemento es la cantidad de protones en el núcleo de un solo átomo de ese elemento. El número atómico de un elemento o isótopo no puede cambiar, por lo que puede usar el número atómico para ayudar a descubrir otras características, como el número de electrones y neutrones en un átomo.
Parte uno de dos:
Encontrar el número atómico
-
 1 Encuentre una copia de la tabla periódica. Tenemos uno aquí si no tienes uno a mano. Cada elemento tiene un número atómico diferente, y los elementos se ordenan en la tabla de acuerdo con sus números atómicos. Es encontrar una copia de la tabla periódica o memorizar una.
1 Encuentre una copia de la tabla periódica. Tenemos uno aquí si no tienes uno a mano. Cada elemento tiene un número atómico diferente, y los elementos se ordenan en la tabla de acuerdo con sus números atómicos. Es encontrar una copia de la tabla periódica o memorizar una. - La mayoría de los libros de texto de química tienen una tabla periódica impresa en la cubierta interior.
-
 2 Encuentra el elemento que estás estudiando. La mayoría de las tablas periódicas incluyen el nombre completo de los elementos, así como el símbolo químico (como Hg para Mercurio). Si tiene problemas para encontrarlo, busque en línea el "símbolo químico" seguido del nombre del elemento.
2 Encuentra el elemento que estás estudiando. La mayoría de las tablas periódicas incluyen el nombre completo de los elementos, así como el símbolo químico (como Hg para Mercurio). Si tiene problemas para encontrarlo, busque en línea el "símbolo químico" seguido del nombre del elemento. -
 3 Busque el número atómico. El número atómico generalmente está en la esquina superior izquierda o superior derecha del cuadro del elemento, pero podría estar en un lugar diferente. Este es siempre un número entero.
3 Busque el número atómico. El número atómico generalmente está en la esquina superior izquierda o superior derecha del cuadro del elemento, pero podría estar en un lugar diferente. Este es siempre un número entero. - Si el número incluye un punto decimal, probablemente estés mirando la masa atómica.
-
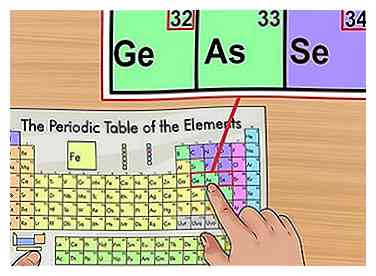 4 Confirmar basado en elementos cercanos. La tabla periódica está ordenada por orden de número atómico. Si el número atómico de su elemento es "33", el elemento de la izquierda debe ser "32" y el elemento de la derecha debe tener un "34". Si este patrón es verdadero, definitivamente has encontrado el número atómico.
4 Confirmar basado en elementos cercanos. La tabla periódica está ordenada por orden de número atómico. Si el número atómico de su elemento es "33", el elemento de la izquierda debe ser "32" y el elemento de la derecha debe tener un "34". Si este patrón es verdadero, definitivamente has encontrado el número atómico. - Puede ver huecos después de los elementos 56 (Barium) y 88 (Radium). No hay una brecha real; los elementos con esos números atómicos están ubicados en dos filas debajo del resto del gráfico. Solo están separados así para adaptarse a la tabla periódica en una forma más estrecha.
-
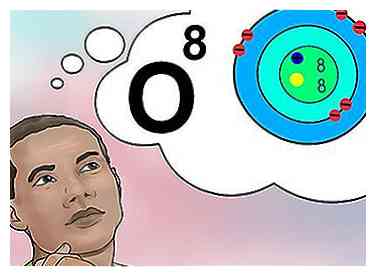 5 Comprende el número atómico. El número atómico de un elemento tiene una definición simple: la cantidad de protones en un átomo de ese elemento.[1] Esta es la definición fundamental de un elemento. La cantidad de protones determina la carga eléctrica total del núcleo, que determina cuántos electrones puede soportar el átomo. Debido a que los electrones son responsables de casi todas las interacciones químicas, el número atómico establece indirectamente casi todas las propiedades físicas y químicas del elemento.
5 Comprende el número atómico. El número atómico de un elemento tiene una definición simple: la cantidad de protones en un átomo de ese elemento.[1] Esta es la definición fundamental de un elemento. La cantidad de protones determina la carga eléctrica total del núcleo, que determina cuántos electrones puede soportar el átomo. Debido a que los electrones son responsables de casi todas las interacciones químicas, el número atómico establece indirectamente casi todas las propiedades físicas y químicas del elemento. - Para decirlo de otra manera, cada átomo con ocho protones es un átomo de oxígeno. Dos átomos de oxígeno pueden tener diferentes números de neutrones o (si se trata de un ion) diferentes números de electrones, pero siempre tendrán ocho protones cada uno.
Parte dos de dos:
Encontrar información relacionada
-
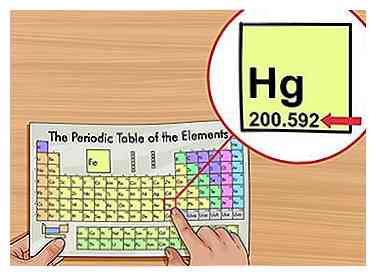 1 Encuentra el peso atómico. El peso atómico generalmente se imprime debajo del nombre del elemento en la tabla periódica, por lo general a dos o tres decimales. Esta es la masa promedio de un átomo del elemento, ponderado según lo que esperaría encontrar en la naturaleza. Este número está en "unidades de masa atómica" (AMU).
1 Encuentra el peso atómico. El peso atómico generalmente se imprime debajo del nombre del elemento en la tabla periódica, por lo general a dos o tres decimales. Esta es la masa promedio de un átomo del elemento, ponderado según lo que esperaría encontrar en la naturaleza. Este número está en "unidades de masa atómica" (AMU). - Algunos científicos prefieren el término "masa atómica relativa" en lugar de peso atómico.[2]
-
 2 Redondea al número masivo. El número de masa es la cantidad total de protones y neutrones en un átomo de un elemento. Esto es fácil de encontrar: simplemente tome el peso atómico impreso en la tabla periódica y redondee al número entero más cercano.[3]
2 Redondea al número masivo. El número de masa es la cantidad total de protones y neutrones en un átomo de un elemento. Esto es fácil de encontrar: simplemente tome el peso atómico impreso en la tabla periódica y redondee al número entero más cercano.[3] - Esto funciona porque los neutrones y protones están muy cerca de 1 AMU, y los electrones están muy cerca de 0 AMU. El peso atómico utiliza medidas precisas para obtener el valor decimal, pero solo nos interesan los números enteros que nos dicen la cantidad de protones y neutrones.
- Recuerde, si usa el peso atómico, obtendrá un promedio para una muestra típica. Una muestra de bromo tiene una masa promedio de 80, pero resulta que un solo átomo de bromo casi siempre tiene un número de masa de 79 u 81.[4]
- 3 Encuentra la cantidad de electrones. Los átomos contienen la misma cantidad de protones y electrones, por lo que estos números serán los mismos. Los electrones tienen carga negativa, por lo que equilibran y neutralizan los protones, que tienen carga positiva.[5]
- Si un átomo pierde o gana electrones, se convierte en un ion, lo que significa que es un átomo cargado eléctricamente.
-
 4 Calcule la cantidad de neutrones. Ahora sabes que número atómico = número de protones, y número de masa = número de protones + número de neutrones. Para encontrar la cantidad de neutrones en un elemento, reste el número atómico del número de masa. Aquí hay un par de ejemplos:
4 Calcule la cantidad de neutrones. Ahora sabes que número atómico = número de protones, y número de masa = número de protones + número de neutrones. Para encontrar la cantidad de neutrones en un elemento, reste el número atómico del número de masa. Aquí hay un par de ejemplos: - Un solo átomo de helio (He) tiene un número de masa de 4 y un número atómico de 2. Debe tener 4 - 2 = 2 neutrones.
- Una muestra de plata (Ag) tiene un número de masa promedio de 108 (basado en la tabla periódica) y un número atómico de 47. En promedio, cada átomo de plata en la muestra tiene 108 - 47 = 61 neutrones.
-
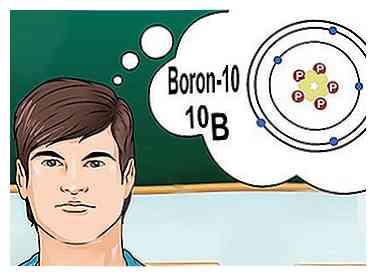 5 Comprender isótopos. Un isótopo es una forma específica de un elemento, con un cierto número de neutrones. Si un problema de química menciona "boron-10" o "boron-10"10B: "está hablando de elementos de boro con un número de masa de 10.[6] Use este número de masa en lugar de los valores para el boro "típico".
5 Comprender isótopos. Un isótopo es una forma específica de un elemento, con un cierto número de neutrones. Si un problema de química menciona "boron-10" o "boron-10"10B: "está hablando de elementos de boro con un número de masa de 10.[6] Use este número de masa en lugar de los valores para el boro "típico". - Los isótopos nunca cambian el número atómico. Cada isótopo de un elemento tiene la misma cantidad de protones.
 Minotauromaquia
Minotauromaquia
 1 Encuentre una copia de la tabla periódica. Tenemos uno aquí si no tienes uno a mano. Cada elemento tiene un número atómico diferente, y los elementos se ordenan en la tabla de acuerdo con sus números atómicos. Es encontrar una copia de la tabla periódica o memorizar una.
1 Encuentre una copia de la tabla periódica. Tenemos uno aquí si no tienes uno a mano. Cada elemento tiene un número atómico diferente, y los elementos se ordenan en la tabla de acuerdo con sus números atómicos. Es encontrar una copia de la tabla periódica o memorizar una.  2 Encuentra el elemento que estás estudiando. La mayoría de las tablas periódicas incluyen el nombre completo de los elementos, así como el símbolo químico (como Hg para Mercurio). Si tiene problemas para encontrarlo, busque en línea el "símbolo químico" seguido del nombre del elemento.
2 Encuentra el elemento que estás estudiando. La mayoría de las tablas periódicas incluyen el nombre completo de los elementos, así como el símbolo químico (como Hg para Mercurio). Si tiene problemas para encontrarlo, busque en línea el "símbolo químico" seguido del nombre del elemento.  3 Busque el número atómico. El número atómico generalmente está en la esquina superior izquierda o superior derecha del cuadro del elemento, pero podría estar en un lugar diferente. Este es siempre un número entero.
3 Busque el número atómico. El número atómico generalmente está en la esquina superior izquierda o superior derecha del cuadro del elemento, pero podría estar en un lugar diferente. Este es siempre un número entero.  4 Confirmar basado en elementos cercanos. La tabla periódica está ordenada por orden de número atómico. Si el número atómico de su elemento es "33", el elemento de la izquierda debe ser "32" y el elemento de la derecha debe tener un "34". Si este patrón es verdadero, definitivamente has encontrado el número atómico.
4 Confirmar basado en elementos cercanos. La tabla periódica está ordenada por orden de número atómico. Si el número atómico de su elemento es "33", el elemento de la izquierda debe ser "32" y el elemento de la derecha debe tener un "34". Si este patrón es verdadero, definitivamente has encontrado el número atómico.  5 Comprende el número atómico. El número atómico de un elemento tiene una definición simple: la cantidad de protones en un átomo de ese elemento.[1] Esta es la definición fundamental de un elemento. La cantidad de protones determina la carga eléctrica total del núcleo, que determina cuántos electrones puede soportar el átomo. Debido a que los electrones son responsables de casi todas las interacciones químicas, el número atómico establece indirectamente casi todas las propiedades físicas y químicas del elemento.
5 Comprende el número atómico. El número atómico de un elemento tiene una definición simple: la cantidad de protones en un átomo de ese elemento.[1] Esta es la definición fundamental de un elemento. La cantidad de protones determina la carga eléctrica total del núcleo, que determina cuántos electrones puede soportar el átomo. Debido a que los electrones son responsables de casi todas las interacciones químicas, el número atómico establece indirectamente casi todas las propiedades físicas y químicas del elemento.  1 Encuentra el peso atómico. El peso atómico generalmente se imprime debajo del nombre del elemento en la tabla periódica, por lo general a dos o tres decimales. Esta es la masa promedio de un átomo del elemento, ponderado según lo que esperaría encontrar en la naturaleza. Este número está en "unidades de masa atómica" (AMU).
1 Encuentra el peso atómico. El peso atómico generalmente se imprime debajo del nombre del elemento en la tabla periódica, por lo general a dos o tres decimales. Esta es la masa promedio de un átomo del elemento, ponderado según lo que esperaría encontrar en la naturaleza. Este número está en "unidades de masa atómica" (AMU).  2 Redondea al número masivo. El número de masa es la cantidad total de protones y neutrones en un átomo de un elemento. Esto es fácil de encontrar: simplemente tome el peso atómico impreso en la tabla periódica y redondee al número entero más cercano.[3]
2 Redondea al número masivo. El número de masa es la cantidad total de protones y neutrones en un átomo de un elemento. Esto es fácil de encontrar: simplemente tome el peso atómico impreso en la tabla periódica y redondee al número entero más cercano.[3]  4 Calcule la cantidad de neutrones. Ahora sabes que número atómico = número de protones, y número de masa = número de protones + número de neutrones. Para encontrar la cantidad de neutrones en un elemento, reste el número atómico del número de masa. Aquí hay un par de ejemplos:
4 Calcule la cantidad de neutrones. Ahora sabes que número atómico = número de protones, y número de masa = número de protones + número de neutrones. Para encontrar la cantidad de neutrones en un elemento, reste el número atómico del número de masa. Aquí hay un par de ejemplos:  5 Comprender isótopos. Un isótopo es una forma específica de un elemento, con un cierto número de neutrones. Si un problema de química menciona "boron-10" o "boron-10"10B: "está hablando de elementos de boro con un número de masa de 10.[6] Use este número de masa en lugar de los valores para el boro "típico".
5 Comprender isótopos. Un isótopo es una forma específica de un elemento, con un cierto número de neutrones. Si un problema de química menciona "boron-10" o "boron-10"10B: "está hablando de elementos de boro con un número de masa de 10.[6] Use este número de masa en lugar de los valores para el boro "típico".