La masa atómica promedio no es una medida directa de un solo átomo. En cambio, es la masa promedio por átomo para una muestra típica de un elemento dado. Si pudieras medir la masa de miles de millones de átomos individuales, podrías calcular este valor de la misma forma que obtendrías un promedio. Afortunadamente, hay un método más práctico que se basa en la información registrada sobre la rareza de diferentes isótopos.
Parte uno de dos:
Cálculo de la masa atómica promedio
-
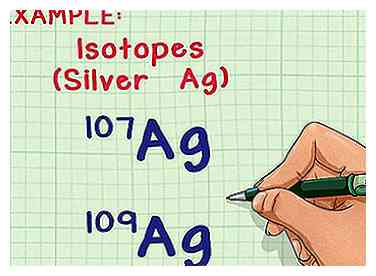 1 Comprender isótopos y masas atómicas. La mayoría de los elementos pueden ocurrir naturalmente en formas múltiples o isótopos. El número de masa para cada isótopo es la suma de números de protones y neutrones en el núcleo. Cada protón y cada neutrón pesan 1 unidad de masa atómica (amu).[1] La única diferencia entre dos isótopos del mismo elemento es la cantidad de neutrones por átomo, lo que afecta la masa del átomo.[2] Sin embargo, el elemento siempre tiene la misma cantidad de protones.
1 Comprender isótopos y masas atómicas. La mayoría de los elementos pueden ocurrir naturalmente en formas múltiples o isótopos. El número de masa para cada isótopo es la suma de números de protones y neutrones en el núcleo. Cada protón y cada neutrón pesan 1 unidad de masa atómica (amu).[1] La única diferencia entre dos isótopos del mismo elemento es la cantidad de neutrones por átomo, lo que afecta la masa del átomo.[2] Sin embargo, el elemento siempre tiene la misma cantidad de protones. - La masa atómica promedio del elemento toma en cuenta las variaciones del número de neutrones y te dice la masa promedio por átomo en una muestra típica de ese elemento.
- Por ejemplo, el elemento plata (Ag) tiene dos isótopos naturales: Ag-107 y Ag-109 (o 107Ag y 109Ag).[3] Los isótopos reciben el nombre del "número de masa" o la suma de protones y neutrones en un átomo.[4] Esto significa que Ag-109 tiene dos neutrones más por átomo que Ag-107, lo que le da un poco más de masa.
-
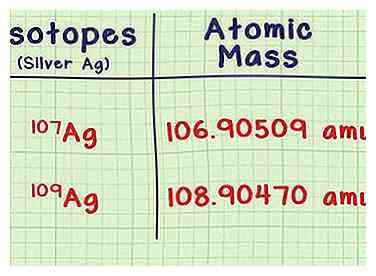 2 Busca la masa de cada isótopo. Necesitará dos piezas de información para cada isótopo, que puede consultar en un libro de referencia o en una fuente en línea como webelements.com. El primero es la masa atómica, o la masa de un átomo de cada isótopo. Los isótopos con más neutrones tienen más masa.
2 Busca la masa de cada isótopo. Necesitará dos piezas de información para cada isótopo, que puede consultar en un libro de referencia o en una fuente en línea como webelements.com. El primero es la masa atómica, o la masa de un átomo de cada isótopo. Los isótopos con más neutrones tienen más masa. - Por ejemplo, el isótopo de plata Ag-107 tiene una masa atómica de 106.90509 amu (unidades de masa atómica). El isótopo Ag-109 es ligeramente más pesado con una masa de 108.90470.
- Los últimos dos lugares decimales pueden ser ligeramente diferentes en diferentes fuentes. No incluya ningún número entre paréntesis después de la misa.
-
 3 Escriba la abundancia de cada isótopo. La abundancia te dice cuán común es el isótopo, como un porcentaje de todos los átomos del elemento. Cada isótopo contribuye proporcionalmente a su abundancia (cuanto más abundante sea el isótopo, más contribuirá a la masa atómica promedio). Puedes encontrar esto en la misma fuente donde encontraste la masa. La abundancia de todos los isótopos debería sumar hasta el 100% (aunque podría estar un poco apagado debido a errores de redondeo).
3 Escriba la abundancia de cada isótopo. La abundancia te dice cuán común es el isótopo, como un porcentaje de todos los átomos del elemento. Cada isótopo contribuye proporcionalmente a su abundancia (cuanto más abundante sea el isótopo, más contribuirá a la masa atómica promedio). Puedes encontrar esto en la misma fuente donde encontraste la masa. La abundancia de todos los isótopos debería sumar hasta el 100% (aunque podría estar un poco apagado debido a errores de redondeo). - El isótopo Ag-107 tiene una abundancia del 51.86%. Ag-109 es ligeramente menos común con una abundancia del 48.14%. Esto significa que una muestra típica de plata es 51.86% Ag-107 y 48.14% Ag-109.
- Ignora cualquier isótopo que no tenga una abundancia en la lista. Estos isótopos no ocurren naturalmente en la Tierra.
-
 4 Convierte tus porcentajes de abundancia en decimales. Divida el porcentaje de abundancia entre 100 para obtener el mismo valor que un decimal.
4 Convierte tus porcentajes de abundancia en decimales. Divida el porcentaje de abundancia entre 100 para obtener el mismo valor que un decimal. - En el problema de la muestra, las cifras de abundancia son 51.86 / 100 = 0.5186 y 48.14 / 100 = 0.4814.
-
 5 Encuentre el promedio ponderado de la masa atómica de sus isótopos estables. La masa atómica promedio de un elemento con norte isótopos iguales (masaisótopo 1 * abundanciaisótopo 1) + (masaisótopo 2 * abundanciaisótopo 2) + ... + (masaisótopo norte * abundanciaisótopo norte.[5] Este es un ejemplo de un "promedio ponderado", lo que significa que las masas más comunes (más abundantes) tienen un mayor efecto en el resultado. A continuación, le indicamos cómo usar esta fórmula para plata:
5 Encuentre el promedio ponderado de la masa atómica de sus isótopos estables. La masa atómica promedio de un elemento con norte isótopos iguales (masaisótopo 1 * abundanciaisótopo 1) + (masaisótopo 2 * abundanciaisótopo 2) + ... + (masaisótopo norte * abundanciaisótopo norte.[5] Este es un ejemplo de un "promedio ponderado", lo que significa que las masas más comunes (más abundantes) tienen un mayor efecto en el resultado. A continuación, le indicamos cómo usar esta fórmula para plata: - Masa atómica promedioAg = (masaAg-107 * abundanciaAg-107) + (masaAg-109 * abundanciaAg-109)
=(106.90509 * 0.5186) + (108.90470 * 0.4814)
= 55.4410 + 52.4267
= 107.8677 amu. - Busque el elemento en una tabla periódica para verificar su respuesta. La masa atómica promedio generalmente se escribe debajo del símbolo del elemento.[6]
- Masa atómica promedioAg = (masaAg-107 * abundanciaAg-107) + (masaAg-109 * abundanciaAg-109)
Parte dos de dos:
Usando el resultado
-
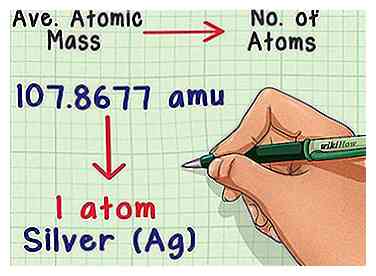 1 Convierta la masa en una cantidad de átomos. La masa atómica promedio te dice la relación entre la masa y el número de átomos en una muestra típica del elemento. Esto es útil en los laboratorios de química porque es casi imposible contar el número de átomos directamente, pero es fácil medir la masa. Por ejemplo, puedes pesar una muestra de plata y predecir que cada 107.8677 amu de masa contiene un átomo de plata.
1 Convierta la masa en una cantidad de átomos. La masa atómica promedio te dice la relación entre la masa y el número de átomos en una muestra típica del elemento. Esto es útil en los laboratorios de química porque es casi imposible contar el número de átomos directamente, pero es fácil medir la masa. Por ejemplo, puedes pesar una muestra de plata y predecir que cada 107.8677 amu de masa contiene un átomo de plata. -
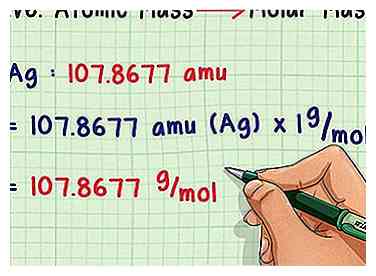 2 Convertir a masa molar. Las unidades de masa atómica son muy pequeñas, por lo que los químicos normalmente pesan muestras en gramos. Afortunadamente, estos conceptos se definen para hacer que la conversión sea lo más fácil posible. Simplemente multiplique la masa atómica promedio por 1 g / mol (la constante de masa molar) para obtener una respuesta en g / mol. Por ejemplo, 107.8677 gramos de plata contienen un mol de átomos de plata en promedio.
2 Convertir a masa molar. Las unidades de masa atómica son muy pequeñas, por lo que los químicos normalmente pesan muestras en gramos. Afortunadamente, estos conceptos se definen para hacer que la conversión sea lo más fácil posible. Simplemente multiplique la masa atómica promedio por 1 g / mol (la constante de masa molar) para obtener una respuesta en g / mol. Por ejemplo, 107.8677 gramos de plata contienen un mol de átomos de plata en promedio. -
 3 Encuentra la masa molecular promedio Como una molécula es solo una colección de átomos, puede agregar las masas de los átomos para encontrar la masa de la molécula. Si usa las masas atómicas promedio (en lugar de la masa de un isótopo específico), la respuesta es la masa promedio de la molécula que se encuentra en una muestra que se produce naturalmente. Aquí hay un ejemplo:
3 Encuentra la masa molecular promedio Como una molécula es solo una colección de átomos, puede agregar las masas de los átomos para encontrar la masa de la molécula. Si usa las masas atómicas promedio (en lugar de la masa de un isótopo específico), la respuesta es la masa promedio de la molécula que se encuentra en una muestra que se produce naturalmente. Aquí hay un ejemplo: - Una molécula de agua tiene la fórmula química H2O, entonces contiene dos átomos de hidrógeno (H) y un átomo de oxígeno (O).
- El hidrógeno tiene una masa atómica promedio de 1.00794 amu. Los átomos de oxígeno tienen una masa promedio de 15.9994 amu.
- La masa promedio de una molécula de H2O es igual a (1.00794) (2) + 15.9994 = 18.01528 amu, equivalente a 18.01528 g / mol.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Comprender isótopos y masas atómicas. La mayoría de los elementos pueden ocurrir naturalmente en formas múltiples o isótopos. El número de masa para cada isótopo es la suma de números de protones y neutrones en el núcleo. Cada protón y cada neutrón pesan 1 unidad de masa atómica (amu).[1] La única diferencia entre dos isótopos del mismo elemento es la cantidad de neutrones por átomo, lo que afecta la masa del átomo.[2] Sin embargo, el elemento siempre tiene la misma cantidad de protones.
1 Comprender isótopos y masas atómicas. La mayoría de los elementos pueden ocurrir naturalmente en formas múltiples o isótopos. El número de masa para cada isótopo es la suma de números de protones y neutrones en el núcleo. Cada protón y cada neutrón pesan 1 unidad de masa atómica (amu).[1] La única diferencia entre dos isótopos del mismo elemento es la cantidad de neutrones por átomo, lo que afecta la masa del átomo.[2] Sin embargo, el elemento siempre tiene la misma cantidad de protones.  2 Busca la masa de cada isótopo. Necesitará dos piezas de información para cada isótopo, que puede consultar en un libro de referencia o en una fuente en línea como webelements.com. El primero es la masa atómica, o la masa de un átomo de cada isótopo. Los isótopos con más neutrones tienen más masa.
2 Busca la masa de cada isótopo. Necesitará dos piezas de información para cada isótopo, que puede consultar en un libro de referencia o en una fuente en línea como webelements.com. El primero es la masa atómica, o la masa de un átomo de cada isótopo. Los isótopos con más neutrones tienen más masa.  3 Escriba la abundancia de cada isótopo. La abundancia te dice cuán común es el isótopo, como un porcentaje de todos los átomos del elemento. Cada isótopo contribuye proporcionalmente a su abundancia (cuanto más abundante sea el isótopo, más contribuirá a la masa atómica promedio). Puedes encontrar esto en la misma fuente donde encontraste la masa. La abundancia de todos los isótopos debería sumar hasta el 100% (aunque podría estar un poco apagado debido a errores de redondeo).
3 Escriba la abundancia de cada isótopo. La abundancia te dice cuán común es el isótopo, como un porcentaje de todos los átomos del elemento. Cada isótopo contribuye proporcionalmente a su abundancia (cuanto más abundante sea el isótopo, más contribuirá a la masa atómica promedio). Puedes encontrar esto en la misma fuente donde encontraste la masa. La abundancia de todos los isótopos debería sumar hasta el 100% (aunque podría estar un poco apagado debido a errores de redondeo).  4 Convierte tus porcentajes de abundancia en decimales. Divida el porcentaje de abundancia entre 100 para obtener el mismo valor que un decimal.
4 Convierte tus porcentajes de abundancia en decimales. Divida el porcentaje de abundancia entre 100 para obtener el mismo valor que un decimal.  5 Encuentre el promedio ponderado de la masa atómica de sus isótopos estables. La masa atómica promedio de un elemento con norte isótopos iguales (masaisótopo 1 * abundanciaisótopo 1) + (masaisótopo 2 * abundanciaisótopo 2) + ... + (masaisótopo norte * abundanciaisótopo norte.[5] Este es un ejemplo de un "promedio ponderado", lo que significa que las masas más comunes (más abundantes) tienen un mayor efecto en el resultado. A continuación, le indicamos cómo usar esta fórmula para plata:
5 Encuentre el promedio ponderado de la masa atómica de sus isótopos estables. La masa atómica promedio de un elemento con norte isótopos iguales (masaisótopo 1 * abundanciaisótopo 1) + (masaisótopo 2 * abundanciaisótopo 2) + ... + (masaisótopo norte * abundanciaisótopo norte.[5] Este es un ejemplo de un "promedio ponderado", lo que significa que las masas más comunes (más abundantes) tienen un mayor efecto en el resultado. A continuación, le indicamos cómo usar esta fórmula para plata:  1 Convierta la masa en una cantidad de átomos. La masa atómica promedio te dice la relación entre la masa y el número de átomos en una muestra típica del elemento. Esto es útil en los laboratorios de química porque es casi imposible contar el número de átomos directamente, pero es fácil medir la masa. Por ejemplo, puedes pesar una muestra de plata y predecir que cada 107.8677 amu de masa contiene un átomo de plata.
1 Convierta la masa en una cantidad de átomos. La masa atómica promedio te dice la relación entre la masa y el número de átomos en una muestra típica del elemento. Esto es útil en los laboratorios de química porque es casi imposible contar el número de átomos directamente, pero es fácil medir la masa. Por ejemplo, puedes pesar una muestra de plata y predecir que cada 107.8677 amu de masa contiene un átomo de plata. 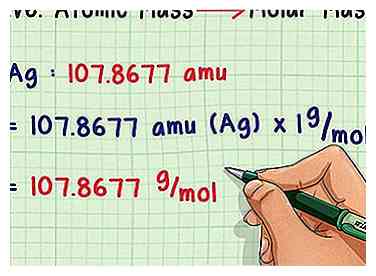 2 Convertir a masa molar. Las unidades de masa atómica son muy pequeñas, por lo que los químicos normalmente pesan muestras en gramos. Afortunadamente, estos conceptos se definen para hacer que la conversión sea lo más fácil posible. Simplemente multiplique la masa atómica promedio por 1 g / mol (la constante de masa molar) para obtener una respuesta en g / mol. Por ejemplo, 107.8677 gramos de plata contienen un mol de átomos de plata en promedio.
2 Convertir a masa molar. Las unidades de masa atómica son muy pequeñas, por lo que los químicos normalmente pesan muestras en gramos. Afortunadamente, estos conceptos se definen para hacer que la conversión sea lo más fácil posible. Simplemente multiplique la masa atómica promedio por 1 g / mol (la constante de masa molar) para obtener una respuesta en g / mol. Por ejemplo, 107.8677 gramos de plata contienen un mol de átomos de plata en promedio.  3 Encuentra la masa molecular promedio Como una molécula es solo una colección de átomos, puede agregar las masas de los átomos para encontrar la masa de la molécula. Si usa las masas atómicas promedio (en lugar de la masa de un isótopo específico), la respuesta es la masa promedio de la molécula que se encuentra en una muestra que se produce naturalmente. Aquí hay un ejemplo:
3 Encuentra la masa molecular promedio Como una molécula es solo una colección de átomos, puede agregar las masas de los átomos para encontrar la masa de la molécula. Si usa las masas atómicas promedio (en lugar de la masa de un isótopo específico), la respuesta es la masa promedio de la molécula que se encuentra en una muestra que se produce naturalmente. Aquí hay un ejemplo: