Si te han asignado tareas donde tienes que encontrar la fórmula empírica de un compuesto, pero no tienes idea de cómo empezar, ¡nunca temas! ¡wikiHow está aquí para ayudar! Primero, eche un vistazo al conocimiento básico que necesita tener para encontrar la fórmula empírica, y luego repase un ejemplo en la Parte 2.
Método uno de dos:
Comprender los conceptos básicos
-
 1 Sepa cuál es la fórmula empírica. En química, la EF es la forma más simple de describir un compuesto; básicamente, es una lista de los elementos que componen un compuesto, organizado por porcentaje. Es importante tener en cuenta que esta fórmula simple no describe el arreglo de los átomos dentro del compuesto, simplemente indica de qué elementos está compuesto el compuesto. Por ejemplo:
1 Sepa cuál es la fórmula empírica. En química, la EF es la forma más simple de describir un compuesto; básicamente, es una lista de los elementos que componen un compuesto, organizado por porcentaje. Es importante tener en cuenta que esta fórmula simple no describe el arreglo de los átomos dentro del compuesto, simplemente indica de qué elementos está compuesto el compuesto. Por ejemplo: - Un compuesto compuesto por 40.92% de Carbono, 4.58% de Hidrógeno y 54.5% de Oxígeno tendría una fórmula empírica de C3H4O3 (veremos un ejemplo de cómo encontrar el EF de este compuesto en la Parte Dos).
-
 2 Comprender el término 'composición porcentual'. 'Composición porcentual' se refiere al porcentaje de cada átomo individual en todo el compuesto que estamos viendo. Para encontrar la fórmula empírica de un compuesto, debemos conocer el porcentaje de composición del compuesto. Si encuentra la fórmula empírica para la tarea, lo más probable es que le den los porcentajes.
2 Comprender el término 'composición porcentual'. 'Composición porcentual' se refiere al porcentaje de cada átomo individual en todo el compuesto que estamos viendo. Para encontrar la fórmula empírica de un compuesto, debemos conocer el porcentaje de composición del compuesto. Si encuentra la fórmula empírica para la tarea, lo más probable es que le den los porcentajes. - En un laboratorio de química, para encontrar la composición porcentual, el compuesto sería examinado a través de algunos experimentos físicos y luego un análisis cuantitativo. A menos que estés en un laboratorio, no necesitarás hacer estos experimentos.
-
 3 Tenga en cuenta que tratará con átomos de gramo. Un átomo de gramo es la cantidad específica de un elemento cuyo peso en gramos es igual a su masa atómica. Para encontrar un átomo de gramo, la ecuación es: El porcentaje del elemento en el compuesto (%) dividido por la masa atómica del elemento.[1]
3 Tenga en cuenta que tratará con átomos de gramo. Un átomo de gramo es la cantidad específica de un elemento cuyo peso en gramos es igual a su masa atómica. Para encontrar un átomo de gramo, la ecuación es: El porcentaje del elemento en el compuesto (%) dividido por la masa atómica del elemento.[1] - Por ejemplo, digamos que tenemos un compuesto que se compone de 40,92% de carbono. La masa atómica de carbono es 12, por lo que nuestra ecuación sería 40.92 / 12 = 3.41.
-
 4 Sepa cómo encontrar la relación atómica. Cuando trabaje con un compuesto, tendrá que calcular más de un átomo de gramo. Después de haber encontrado todos los átomos de gramo en su compuesto, mire todos. Para encontrar la relación atómica, deberá elegir el átomo del gramo que sea el más pequeño de todos los átomos de gramos que calculó. Luego dividirás todos tus átomos de gramos por el átomo de gramo más pequeño. Por ejemplo:
4 Sepa cómo encontrar la relación atómica. Cuando trabaje con un compuesto, tendrá que calcular más de un átomo de gramo. Después de haber encontrado todos los átomos de gramo en su compuesto, mire todos. Para encontrar la relación atómica, deberá elegir el átomo del gramo que sea el más pequeño de todos los átomos de gramos que calculó. Luego dividirás todos tus átomos de gramos por el átomo de gramo más pequeño. Por ejemplo: - Digamos que estamos trabajando con un compuesto que tiene tres átomos de gramo: 1.5, 2 y 2.5. El átomo gramo más pequeño de esos tres números es 1.5. Entonces, para encontrar la relación atómica, debe dividir todos los números por 1.5 y luego separarlos con el símbolo de relación :.
- 1.5 / 1.5 = 1. 2 / 1.5 = 1.33. 2.5 / 1.5 = 1.66. Entonces, tu proporción atómica es 1 : 1.33 : 1.66.
-
 5 Comprenda cómo convertir números de relación atómica en números enteros. Al escribir una fórmula empírica, necesitas números enteros. Esto significa que no puede usar un número como 1.33. Después de haber encontrado su relación atómica, debe convertir cualquier número parcial (nuevamente, como 1.33) en números enteros (como 3). Para hacer esto, debes encontrar un número entero que pueda multiplicarse por cada número individual en tu proporción atómica para obtener un número entero. Por ejemplo:
5 Comprenda cómo convertir números de relación atómica en números enteros. Al escribir una fórmula empírica, necesitas números enteros. Esto significa que no puede usar un número como 1.33. Después de haber encontrado su relación atómica, debe convertir cualquier número parcial (nuevamente, como 1.33) en números enteros (como 3). Para hacer esto, debes encontrar un número entero que pueda multiplicarse por cada número individual en tu proporción atómica para obtener un número entero. Por ejemplo: - Pruebe 2. Multiplique los números en su proporción atómica (1, 1.33 y 1.66) por 2. Obtiene 2, 2.66 y 3.32. Estos no son números enteros, entonces 2 no funciona.
- Pruebe 3. Obtiene 3, 4 y 5 cuando multiplica 1, 1.33 y 1.66 por 3. Por lo tanto, su relación atómica de números enteros es 3 : 4 : 5.
-
 6 Comprenda qué significan esos números enteros para la fórmula empírica. La relación de números enteros que acabamos de resolver en realidad se ajusta a la fórmula empírica. Esos tres números enteros son los pequeños números que cuelgan al pie de cada letra que representa un elemento separado del compuesto. Por ejemplo, nuestra fórmula empírica compuesta se vería así:
6 Comprenda qué significan esos números enteros para la fórmula empírica. La relación de números enteros que acabamos de resolver en realidad se ajusta a la fórmula empírica. Esos tres números enteros son los pequeños números que cuelgan al pie de cada letra que representa un elemento separado del compuesto. Por ejemplo, nuestra fórmula empírica compuesta se vería así: - X3Y4Z5
Método dos de dos:
Encontrar la fórmula empírica
-
 1 Determine la composición porcentual de su compuesto. Si está tratando de encontrar la fórmula empírica para una tarea, lo más probable es que le den la composición porcentual; solo necesita saber dónde buscar. Por ejemplo:
1 Determine la composición porcentual de su compuesto. Si está tratando de encontrar la fórmula empírica para una tarea, lo más probable es que le den la composición porcentual; solo necesita saber dónde buscar. Por ejemplo: - Digamos que la tarea le pide que mire una muestra de vitamina C. En ella figura el 40.92% de carbono, el 4.58% de hidrógeno, el 54.5% de oxígeno; esta es la composición porcentual.
- 40.92% de la vitamina C está compuesta de carbono, mientras que el resto está compuesto por 4.58% de hidrógeno y 54.5% de oxígeno.
-
 2 Encuentra la cantidad de átomos de gramo en el compuesto. Como se discutió en la Parte 1, la ecuación para encontrar el número de átomos de gramos es: El porcentaje del elemento en el compuesto (%) dividido por la masa atómica del elemento. Para nuestro ejemplo, la masa atómica de carbono es 12, el hidrógeno es 1 y el oxígeno es 16.
2 Encuentra la cantidad de átomos de gramo en el compuesto. Como se discutió en la Parte 1, la ecuación para encontrar el número de átomos de gramos es: El porcentaje del elemento en el compuesto (%) dividido por la masa atómica del elemento. Para nuestro ejemplo, la masa atómica de carbono es 12, el hidrógeno es 1 y el oxígeno es 16. - Número de átomos de gramo de carbono = 40,92 / 12 = 3,41
- Cantidad de átomos de gramos de hidrógeno = 04.58 / 01 = 4.58
- Número de átomos de gramos de oxígeno = 54.50 / 16 = 3.41
-
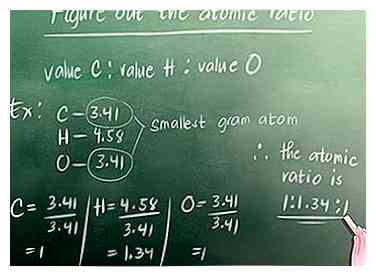 3 Calcula la relación atómica. Busque el átomo de gramo que es el más pequeño de todos los átomos de gramo que acabamos de calcular. Para nuestro ejemplo, esto es 3.41 (carbono u oxígeno, ambos tienen el mismo valor). A continuación, debe dividir todos los valores del átomo del gramo por este número. Usted escribe la proporción así: valor Carbono: valor Hidrógeno: valor Oxígeno.
3 Calcula la relación atómica. Busque el átomo de gramo que es el más pequeño de todos los átomos de gramo que acabamos de calcular. Para nuestro ejemplo, esto es 3.41 (carbono u oxígeno, ambos tienen el mismo valor). A continuación, debe dividir todos los valores del átomo del gramo por este número. Usted escribe la proporción así: valor Carbono: valor Hidrógeno: valor Oxígeno. - Carbono: 3.41 / 3.41 = 1
- Hidrógeno: 4.58 / 3.41 = 1.34
- Oxígeno: 3.41 / 3.41 = 1
- La relación atómica es 1 : 1.34 : 1.
-
 4 Convierta la relación en números enteros. Si su proporción atómica tiene números enteros, puede omitir este paso. Para nuestro ejemplo, sin embargo, tenemos que convertir 1.34 a un número entero.Nuestro número entero más pequeño que se puede multiplicar con los números en nuestra relación atómica para crear números enteros es 3.
4 Convierta la relación en números enteros. Si su proporción atómica tiene números enteros, puede omitir este paso. Para nuestro ejemplo, sin embargo, tenemos que convertir 1.34 a un número entero.Nuestro número entero más pequeño que se puede multiplicar con los números en nuestra relación atómica para crear números enteros es 3. - 1 x 3 = 3 (esto funciona porque 3 es un número entero).
- 1.34 x 3 = 4 (4 es también un número entero).
- 1 x 3 = 3 (nuevamente, 3 es un número entero).
- Nuestra relación de números enteros es, por lo tanto, Carbono (C): Hidrógeno (H): Oxígeno (O) = 3 : 4 : 3
-
 5 Escriba la fórmula empírica. Para hacer esto, todo lo que tiene que hacer es escribir las letras de cada componente, en este caso C para carbono, H para hidrógeno y O para oxígeno, con sus contrapartes de números enteros como subíndices. La fórmula empírica para nuestro ejemplo es:
5 Escriba la fórmula empírica. Para hacer esto, todo lo que tiene que hacer es escribir las letras de cada componente, en este caso C para carbono, H para hidrógeno y O para oxígeno, con sus contrapartes de números enteros como subíndices. La fórmula empírica para nuestro ejemplo es: - do3H4O3
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Sepa cuál es la fórmula empírica. En química, la EF es la forma más simple de describir un compuesto; básicamente, es una lista de los elementos que componen un compuesto, organizado por porcentaje. Es importante tener en cuenta que esta fórmula simple no describe el arreglo de los átomos dentro del compuesto, simplemente indica de qué elementos está compuesto el compuesto. Por ejemplo:
1 Sepa cuál es la fórmula empírica. En química, la EF es la forma más simple de describir un compuesto; básicamente, es una lista de los elementos que componen un compuesto, organizado por porcentaje. Es importante tener en cuenta que esta fórmula simple no describe el arreglo de los átomos dentro del compuesto, simplemente indica de qué elementos está compuesto el compuesto. Por ejemplo:  2 Comprender el término 'composición porcentual'. 'Composición porcentual' se refiere al porcentaje de cada átomo individual en todo el compuesto que estamos viendo. Para encontrar la fórmula empírica de un compuesto, debemos conocer el porcentaje de composición del compuesto. Si encuentra la fórmula empírica para la tarea, lo más probable es que le den los porcentajes.
2 Comprender el término 'composición porcentual'. 'Composición porcentual' se refiere al porcentaje de cada átomo individual en todo el compuesto que estamos viendo. Para encontrar la fórmula empírica de un compuesto, debemos conocer el porcentaje de composición del compuesto. Si encuentra la fórmula empírica para la tarea, lo más probable es que le den los porcentajes.  3 Tenga en cuenta que tratará con átomos de gramo. Un átomo de gramo es la cantidad específica de un elemento cuyo peso en gramos es igual a su masa atómica. Para encontrar un átomo de gramo, la ecuación es: El porcentaje del elemento en el compuesto (%) dividido por la masa atómica del elemento.[1]
3 Tenga en cuenta que tratará con átomos de gramo. Un átomo de gramo es la cantidad específica de un elemento cuyo peso en gramos es igual a su masa atómica. Para encontrar un átomo de gramo, la ecuación es: El porcentaje del elemento en el compuesto (%) dividido por la masa atómica del elemento.[1]  4 Sepa cómo encontrar la relación atómica. Cuando trabaje con un compuesto, tendrá que calcular más de un átomo de gramo. Después de haber encontrado todos los átomos de gramo en su compuesto, mire todos. Para encontrar la relación atómica, deberá elegir el átomo del gramo que sea el más pequeño de todos los átomos de gramos que calculó. Luego dividirás todos tus átomos de gramos por el átomo de gramo más pequeño. Por ejemplo:
4 Sepa cómo encontrar la relación atómica. Cuando trabaje con un compuesto, tendrá que calcular más de un átomo de gramo. Después de haber encontrado todos los átomos de gramo en su compuesto, mire todos. Para encontrar la relación atómica, deberá elegir el átomo del gramo que sea el más pequeño de todos los átomos de gramos que calculó. Luego dividirás todos tus átomos de gramos por el átomo de gramo más pequeño. Por ejemplo:  5 Comprenda cómo convertir números de relación atómica en números enteros. Al escribir una fórmula empírica, necesitas números enteros. Esto significa que no puede usar un número como 1.33. Después de haber encontrado su relación atómica, debe convertir cualquier número parcial (nuevamente, como 1.33) en números enteros (como 3). Para hacer esto, debes encontrar un número entero que pueda multiplicarse por cada número individual en tu proporción atómica para obtener un número entero. Por ejemplo:
5 Comprenda cómo convertir números de relación atómica en números enteros. Al escribir una fórmula empírica, necesitas números enteros. Esto significa que no puede usar un número como 1.33. Después de haber encontrado su relación atómica, debe convertir cualquier número parcial (nuevamente, como 1.33) en números enteros (como 3). Para hacer esto, debes encontrar un número entero que pueda multiplicarse por cada número individual en tu proporción atómica para obtener un número entero. Por ejemplo:  6 Comprenda qué significan esos números enteros para la fórmula empírica. La relación de números enteros que acabamos de resolver en realidad se ajusta a la fórmula empírica. Esos tres números enteros son los pequeños números que cuelgan al pie de cada letra que representa un elemento separado del compuesto. Por ejemplo, nuestra fórmula empírica compuesta se vería así:
6 Comprenda qué significan esos números enteros para la fórmula empírica. La relación de números enteros que acabamos de resolver en realidad se ajusta a la fórmula empírica. Esos tres números enteros son los pequeños números que cuelgan al pie de cada letra que representa un elemento separado del compuesto. Por ejemplo, nuestra fórmula empírica compuesta se vería así:  1 Determine la composición porcentual de su compuesto. Si está tratando de encontrar la fórmula empírica para una tarea, lo más probable es que le den la composición porcentual; solo necesita saber dónde buscar. Por ejemplo:
1 Determine la composición porcentual de su compuesto. Si está tratando de encontrar la fórmula empírica para una tarea, lo más probable es que le den la composición porcentual; solo necesita saber dónde buscar. Por ejemplo:  2 Encuentra la cantidad de átomos de gramo en el compuesto. Como se discutió en la Parte 1, la ecuación para encontrar el número de átomos de gramos es: El porcentaje del elemento en el compuesto (%) dividido por la masa atómica del elemento. Para nuestro ejemplo, la masa atómica de carbono es 12, el hidrógeno es 1 y el oxígeno es 16.
2 Encuentra la cantidad de átomos de gramo en el compuesto. Como se discutió en la Parte 1, la ecuación para encontrar el número de átomos de gramos es: El porcentaje del elemento en el compuesto (%) dividido por la masa atómica del elemento. Para nuestro ejemplo, la masa atómica de carbono es 12, el hidrógeno es 1 y el oxígeno es 16. 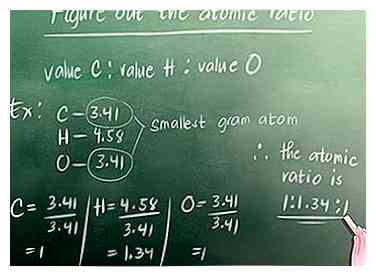 3 Calcula la relación atómica. Busque el átomo de gramo que es el más pequeño de todos los átomos de gramo que acabamos de calcular. Para nuestro ejemplo, esto es 3.41 (carbono u oxígeno, ambos tienen el mismo valor). A continuación, debe dividir todos los valores del átomo del gramo por este número. Usted escribe la proporción así: valor Carbono: valor Hidrógeno: valor Oxígeno.
3 Calcula la relación atómica. Busque el átomo de gramo que es el más pequeño de todos los átomos de gramo que acabamos de calcular. Para nuestro ejemplo, esto es 3.41 (carbono u oxígeno, ambos tienen el mismo valor). A continuación, debe dividir todos los valores del átomo del gramo por este número. Usted escribe la proporción así: valor Carbono: valor Hidrógeno: valor Oxígeno.  4 Convierta la relación en números enteros. Si su proporción atómica tiene números enteros, puede omitir este paso. Para nuestro ejemplo, sin embargo, tenemos que convertir 1.34 a un número entero.Nuestro número entero más pequeño que se puede multiplicar con los números en nuestra relación atómica para crear números enteros es 3.
4 Convierta la relación en números enteros. Si su proporción atómica tiene números enteros, puede omitir este paso. Para nuestro ejemplo, sin embargo, tenemos que convertir 1.34 a un número entero.Nuestro número entero más pequeño que se puede multiplicar con los números en nuestra relación atómica para crear números enteros es 3.  5 Escriba la fórmula empírica. Para hacer esto, todo lo que tiene que hacer es escribir las letras de cada componente, en este caso C para carbono, H para hidrógeno y O para oxígeno, con sus contrapartes de números enteros como subíndices. La fórmula empírica para nuestro ejemplo es:
5 Escriba la fórmula empírica. Para hacer esto, todo lo que tiene que hacer es escribir las letras de cada componente, en este caso C para carbono, H para hidrógeno y O para oxígeno, con sus contrapartes de números enteros como subíndices. La fórmula empírica para nuestro ejemplo es: