Pasar una clase de química general requiere una buena comprensión de los fundamentos, la capacidad de hacer algunas matemáticas básicas, usar una calculadora para ecuaciones más avanzadas y la voluntad de adquirir conocimientos sobre un tema complejo. La química es el estudio de la materia y sus propiedades. Todo a tu alrededor involucra la química. Incluso cosas simples que puedes dar por sentado, como el agua que bebes y el aire que respiras. Mantenga una mente abierta mientras aprende sobre lo que está sucediendo en todas partes a su alrededor, hasta el nivel atómico. Su primera exposición a la química puede ser desafiante y emocionante.
Parte uno de ocho:
Comprender las estructuras atómicas
-
 1 Comience con la estructura más básica. Para aprobar tu clase de química, necesitarás tener una buena comprensión de los elementos básicos que componen todo lo que tiene sustancia o masa.
1 Comience con la estructura más básica. Para aprobar tu clase de química, necesitarás tener una buena comprensión de los elementos básicos que componen todo lo que tiene sustancia o masa. - El átomo es donde comienza la química. Todo en la clase será una extensión, basada en esa información básica. Asegúrese de tomarse el tiempo para comprender el material presentado en los átomos.
-
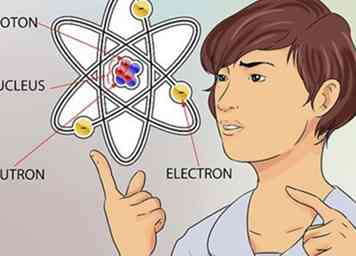 2 Comprende el concepto de un átomo. Un átomo se considera el bloque de construcción más pequeño de todo lo que tiene masa, incluidas las cosas que no siempre podemos ver, como los gases. Pero incluso el pequeño átomo tiene partes aún más pequeñas que conforman su estructura.[1]
2 Comprende el concepto de un átomo. Un átomo se considera el bloque de construcción más pequeño de todo lo que tiene masa, incluidas las cosas que no siempre podemos ver, como los gases. Pero incluso el pequeño átomo tiene partes aún más pequeñas que conforman su estructura.[1] - Un átomo está hecho de 3 partes. Esas partes son neutrones, protones y electrones. El centro del átomo se llama núcleo. El núcleo está formado por neutrones y protones. Los electrones son las partículas que flotan alrededor de la parte exterior del átomo, como los planetas que giran alrededor del sol.[2]
- El tamaño de un átomo es increíblemente pequeño. Para darle un poco de perspectiva, piense en la arena deportiva más grande que conoce, tal vez en el Astrodome de Houston. Si considera que el Astrodome es el átomo, entonces el núcleo de ese átomo es aproximadamente del tamaño de un guisante en algún lugar alrededor de la línea de 50 yardas.[3]
-
 3 Comprender el marco atómico de un elemento. Se considera que un elemento es una sustancia en la naturaleza que no puede descomponerse en ningún otro elemento (s) ni en ninguna otra forma más simple. Los elementos están hechos de átomos.[4]
3 Comprender el marco atómico de un elemento. Se considera que un elemento es una sustancia en la naturaleza que no puede descomponerse en ningún otro elemento (s) ni en ninguna otra forma más simple. Los elementos están hechos de átomos.[4] - Los átomos de un elemento específico son siempre los mismos. Esto significa que cada elemento tiene un número conocido y único de neutrones y protones en su estructura atómica.[5]
-
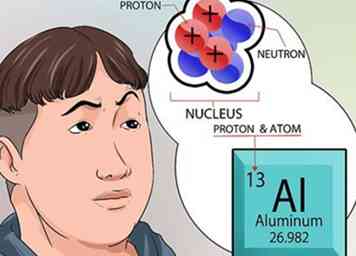 4 Comprende más sobre el núcleo. Los neutrones, que se encuentran en el núcleo, son neutrales a cargo. Los protones tienen una carga positiva. El número atómico de un elemento es exactamente el mismo que el número de protones contenidos en el núcleo.[6]
4 Comprende más sobre el núcleo. Los neutrones, que se encuentran en el núcleo, son neutrales a cargo. Los protones tienen una carga positiva. El número atómico de un elemento es exactamente el mismo que el número de protones contenidos en el núcleo.[6] - No tiene que calcular nada para saber la cantidad de protones en el núcleo de un elemento. Ese número está impreso en la parte superior de cada cuadro cuadrado, para cada elemento, en la tabla periódica.
-
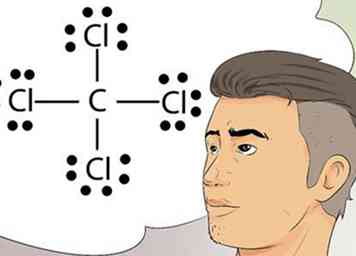 5 Reconoce los diagramas de Lewis. Los diagramas de Lewis a veces se llaman diagramas de electrones. Estos son diagramas simples que usan puntos para representar los electrones apareados y no apareados en la capa externa de un átomo.[7]
5 Reconoce los diagramas de Lewis. Los diagramas de Lewis a veces se llaman diagramas de electrones. Estos son diagramas simples que usan puntos para representar los electrones apareados y no apareados en la capa externa de un átomo.[7] - Las estructuras de Lewis son útiles para dibujar diagramas simples que identifican enlaces, como enlaces covalentes, que se comparten entre elementos en un átomo o molécula.[8]
-
 6 Sepa lo que significa la regla del octeto. Los diagramas de Lewis operan en la regla del octeto, que establece que los átomos son estables cuando tiene acceso a ocho electrones en la capa externa. El hidrógeno es la excepción, y se considera estable con dos electrones en la capa exterior.[9]
6 Sepa lo que significa la regla del octeto. Los diagramas de Lewis operan en la regla del octeto, que establece que los átomos son estables cuando tiene acceso a ocho electrones en la capa externa. El hidrógeno es la excepción, y se considera estable con dos electrones en la capa exterior.[9] -
 7 Dibuja un diagrama de Lewis. El símbolo de un elemento, rodeado por una disposición de puntos, es un diagrama de Lewis. Piense en el diagrama como un fotograma fijo de una película. En lugar de que los electrones se arremolinen alrededor del exterior del elemento, se representan como un momento fijo en el tiempo.[10]
7 Dibuja un diagrama de Lewis. El símbolo de un elemento, rodeado por una disposición de puntos, es un diagrama de Lewis. Piense en el diagrama como un fotograma fijo de una película. En lugar de que los electrones se arremolinen alrededor del exterior del elemento, se representan como un momento fijo en el tiempo.[10] - El diagrama muestra la disposición estable de los electrones, donde se unen al siguiente elemento, y la información sobre la fortaleza de los bonos, como si los bonos se comparten o se duplican.
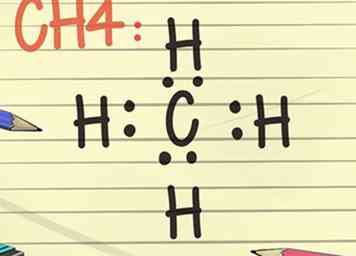
- Piense en la regla del octeto y represente el símbolo de un elemento, quizás C para el carbono. Ahora coloque o imagine 2 puntos en cada posición de la brújula, lo que significa 2 puntos al norte de la C, al este, al oeste y al sur. Ahora imagine una H, que representa un átomo de hidrógeno en el otro lado de cada uno de los 2 puntos. Este diagrama completo de Lewis significa que el único átomo de carbono en el centro está rodeado por 4 átomos de hidrógeno. Los electrones están unidos de forma covalente, lo que significa que los átomos de carbono e hidrógeno comparten uno de sus electrones para unirse entre sí.[11]
- La fórmula molecular para este ejemplo es CH4 y es la fórmula del gas metano.
-
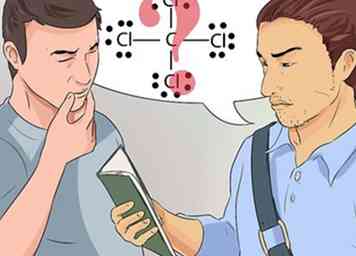 8 Comprenda la disposición de los electrones a medida que unen los elementos. Los diagramas de Lewis son una representación visual simplista de lo que se entiende acerca de los enlaces químicos.
8 Comprenda la disposición de los electrones a medida que unen los elementos. Los diagramas de Lewis son una representación visual simplista de lo que se entiende acerca de los enlaces químicos. - Hable con su profesor o miembros de su grupo de estudio si los conceptos sobre enlaces químicos y diagramas de Lewis no están claros.
Parte dos de ocho:
Lectura y comprensión de la tabla periódica
-
 1 Mira la tabla periódica. Si tiene problemas con las propiedades de los elementos, dedique un tiempo a revisar cualquier material disponible en la tabla periódica. Lo más importante, mira de cerca a uno.
1 Mira la tabla periódica. Si tiene problemas con las propiedades de los elementos, dedique un tiempo a revisar cualquier material disponible en la tabla periódica. Lo más importante, mira de cerca a uno. - Comprender la tabla periódica es fundamental para pasar la primera parte de su clase de química.
- 2 Identifica los elementos en la tabla periódica. La tabla periódica está compuesta de solo elementos. Cada elemento tiene un símbolo que consiste en una o dos letras. Ese símbolo siempre identifica ese elemento. Na, por ejemplo, siempre significa sodio. El nombre completo del elemento aparece justo debajo del símbolo.[12]
- 3 Ubica el número atómico de cada elemento. El número sobre el símbolo es el número atómico. El número atómico es el mismo que el número de protones encontrados en el núcleo.[13]
-
 4 Encuentra la masa atómica de cada elemento. El número en la parte inferior es la masa atómica. Recuerde, la cantidad de protones combinados con la cantidad de neutrones que se encuentran en el núcleo es igual al número de masa atómica.[14]
4 Encuentra la masa atómica de cada elemento. El número en la parte inferior es la masa atómica. Recuerde, la cantidad de protones combinados con la cantidad de neutrones que se encuentran en el núcleo es igual al número de masa atómica.[14] -
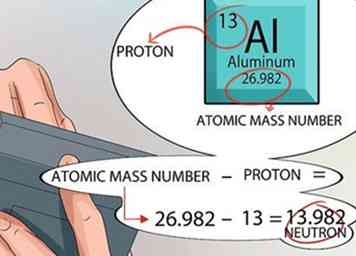 5 Calcule la cantidad de neutrones que se encuentran en el núcleo. Puede usar los números provistos en la tabla periódica para resolver esto. El número atómico para cualquier elemento es exactamente el mismo que el número de protones encontrados en el núcleo.
5 Calcule la cantidad de neutrones que se encuentran en el núcleo. Puede usar los números provistos en la tabla periódica para resolver esto. El número atómico para cualquier elemento es exactamente el mismo que el número de protones encontrados en el núcleo. - La unidad de masa atómica se imprime para cada elemento dentro del cuadrado en la parte inferior, justo debajo del nombre del elemento.
- Recuerde, las únicas dos cosas que están en el núcleo de un átomo son protones y neutrones. La tabla periódica te dice la cantidad de protones y te dice el número de masa atómica.
- A partir de ese punto, las matemáticas son simples. Reste la cantidad de protones del número de masa atómica, y eso le da la cantidad de neutrones en el núcleo de cada átomo para ese elemento.[15]
-
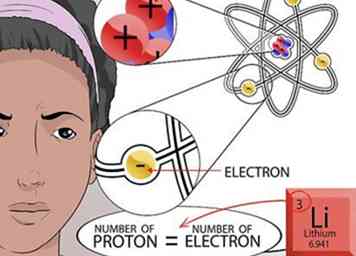 6 Calcula la cantidad de electrones. Recuerde que los opuestos se atraen. Los electrones son partículas con carga positiva que vuelan alrededor del núcleo de un átomo, como los planetas que giran alrededor del sol. La cantidad de electrones cargados negativamente que se extraen hacia el núcleo depende del número de protones cargados positivamente ubicados en el núcleo.
6 Calcula la cantidad de electrones. Recuerde que los opuestos se atraen. Los electrones son partículas con carga positiva que vuelan alrededor del núcleo de un átomo, como los planetas que giran alrededor del sol. La cantidad de electrones cargados negativamente que se extraen hacia el núcleo depende del número de protones cargados positivamente ubicados en el núcleo. - Como un átomo no tiene carga global, todas las cargas positivas y negativas contenidas en el átomo deben equilibrarse. Por lo tanto, la cantidad de electrones es igual a la cantidad de protones.[16]
Parte tres de ocho:
Predicción de reacciones químicas
-
 1 Balancee una ecuación química. En una clase de química, se espera que sepas cómo predecir lo que sucederá cuando los elementos se combinen. En papel, esto se llama equilibrar ecuaciones químicas.[17]
1 Balancee una ecuación química. En una clase de química, se espera que sepas cómo predecir lo que sucederá cuando los elementos se combinen. En papel, esto se llama equilibrar ecuaciones químicas.[17] - El formato para una ecuación química consiste en reactivos en el lado izquierdo de la ecuación, luego una flecha en la dirección de los productos de la ecuación, luego los productos. Las partes en un lado de la ecuación tienen que equilibrar las partes en el otro.[18]
- Por ejemplo, Reactivo 1 + Reactivo 2 → Producto 1 + Producto 2
- Aquí hay un ejemplo que usa los símbolos para Tin, que es Sn, en su forma oxidada, que es SnO2, combinado con gas de hidrógeno, que se escribe como H2. SnO2 + H2 → Sn + H2O.
- Pero esta ecuación no está equilibrada ya que la cantidad de reactivos debe ser igual a la cantidad de productos. El lado izquierdo tiene un átomo de oxígeno más que el lado derecho.[19]
- Usa la matemática básica para equilibrar la ecuación indicando 2 unidades de hidrógeno en el lado izquierdo de la ecuación y 2 moléculas de agua en la derecha. La ecuación balanceada final se ve así: SnO2 + H2 H2 → Sn + H2O.[20]
-
 2 Piensa en las ecuaciones de manera diferente. Si tiene problemas para equilibrar las ecuaciones químicas, piense en la ecuación como parte de una receta, pero una que necesite ajustarse en ambos lados, para que pueda obtener más de menos de su receta.
2 Piensa en las ecuaciones de manera diferente. Si tiene problemas para equilibrar las ecuaciones químicas, piense en la ecuación como parte de una receta, pero una que necesite ajustarse en ambos lados, para que pueda obtener más de menos de su receta. - La ecuación te da los ingredientes, en el lado izquierdo de la ecuación, pero no te dice cuánto usar de cada ingrediente. La ecuación también le dice qué incluirán los productos, pero nuevamente no le informa la cantidad de los productos. Tienes que descubrirlo.
- Usando el ejemplo anterior, SnO2 + H2 → Sn + H2O, considere por qué esta ecuación, o fórmula de receta, no funcionará. Las partes Sn son iguales en ambos lados, y las partes H2 son iguales en ambos lados. Pero el lado izquierdo tiene 2 partes de oxígeno, y el lado derecho tiene solo 1 de oxígeno.
- Cambie el lado derecho de la ecuación para indicar que el producto contendrá 2 partes H2O. El 2 en frente del H2O significa que todas las cantidades en esa agrupación ahora se duplicaron. Así que ahora el oxígeno se equilibra, pero agregar el 2 significa que hay más hidrógeno en el lado derecho de la ecuación que en el izquierdo. Regrese a la izquierda y cambie el ingrediente H2 para que sea el doble, colocando un 2 en frente del H2.
- Ahora ha ajustado los ingredientes en ambos lados de la ecuación. Lo que entra en la receta y lo que sale son iguales o equilibrados.
-
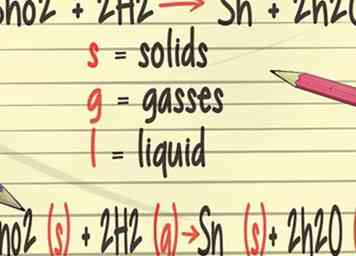 3 Agregue más detalles a sus ecuaciones equilibradas. En tu clase de química, aprenderás a agregar símbolos a tus ecuaciones equilibradas que representan el estado físico de los elementos. Estos símbolos incluirán (s) para sólidos, (g) para gases y (l) para líquidos.[21]
3 Agregue más detalles a sus ecuaciones equilibradas. En tu clase de química, aprenderás a agregar símbolos a tus ecuaciones equilibradas que representan el estado físico de los elementos. Estos símbolos incluirán (s) para sólidos, (g) para gases y (l) para líquidos.[21] -
 4 Identifica los cambios que ocurren en una reacción química. Las reacciones químicas comienzan con los elementos básicos, o elementos ya combinados, llamados reactivos. La combinación de dos o más reactivos en conjunto da como resultado un solo producto o varios productos.
4 Identifica los cambios que ocurren en una reacción química. Las reacciones químicas comienzan con los elementos básicos, o elementos ya combinados, llamados reactivos. La combinación de dos o más reactivos en conjunto da como resultado un solo producto o varios productos. - Para aprobar la química, deberá saber cómo resolver ecuaciones que involucran reactivos químicos, productos y la introducción de alguna otra influencia que altere los reactivos, los productos o ambos.[22]
Parte cuatro de ocho:
Identificación de reacciones químicas
-
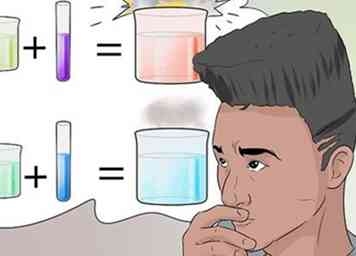 1 Reconoce los tipos de reacciones. Las reacciones químicas pueden ocurrir como resultado de muchas influencias, además de simplemente combinar ingredientes.
1 Reconoce los tipos de reacciones. Las reacciones químicas pueden ocurrir como resultado de muchas influencias, además de simplemente combinar ingredientes. - Los tipos comunes de reacciones químicas que puede esperar conocer incluyen síntesis, análisis, sustitución, doble desplazamiento, base ácida, oxidación-reducción, combustión, isomerización e hidrólisis.[23]
- Los tipos de reacciones presentadas en su clase de química pueden variar, dependiendo de los objetivos de cada clase. La química de la escuela secundaria puede no proporcionar el mismo nivel de detalle que la química aplicada en un colegio o universidad.
-
 2 Use los recursos provistos. Deberá comprender las diferencias en cada tipo de reacción abarcada en su clase. Use los recursos puestos a su disposición por su profesor o profesor para comprender los diferentes tipos de reacciones cubiertas en su clase. No tengas miedo de hacer preguntas.
2 Use los recursos provistos. Deberá comprender las diferencias en cada tipo de reacción abarcada en su clase. Use los recursos puestos a su disposición por su profesor o profesor para comprender los diferentes tipos de reacciones cubiertas en su clase. No tengas miedo de hacer preguntas. - Comprender los cambios que ocurren con diferentes tipos de reacciones químicas puede ser confuso. Comprender lo que sucede durante las reacciones químicas específicas puede ser una sección desafiante de su clase de química.
-
 3 Piensa en las reacciones químicas lógicamente. Trate de no hacer que sea más difícil de lo que ya es al quedar atrapado en la terminología.Los tipos de reacciones químicas que aprenderá simplemente implican hacer algo para cambiar algo.
3 Piensa en las reacciones químicas lógicamente. Trate de no hacer que sea más difícil de lo que ya es al quedar atrapado en la terminología.Los tipos de reacciones químicas que aprenderá simplemente implican hacer algo para cambiar algo. - Por ejemplo, ya sabes lo que sucede cuando combinas 2 átomos de hidrógeno con 1 átomo de oxígeno, obtienes agua. Entonces, si pones esa agua que acabas de hacer en una olla y la pones en la estufa usando calor, algo cambia. Usted creó una reacción química. Si pones esa agua en el congelador, lo mismo. Introdujo un cambio que alteró el reactivo original, el agua en este caso.
- Repase uno por uno cada tipo de reacción hasta que lo comprenda, luego continúe con el siguiente tipo. Concéntrese en la fuente de energía que impulsa la reacción y en los principales cambios que resultan.
- Si tiene problemas en esta área, haga una lista de lo que le resulta confuso y repáselo con su profesor, su grupo de estudio o alguien que conozca bien la química.
Parte cinco de ocho:
Usando el lenguaje de la química
-
 1 Aprenda cómo se nombran los compuestos. La química tiene sus propias reglas para la nomenclatura. Los tipos de reacciones que suceden a los compuestos químicos, la pérdida o ganancia de electrones en su capa exterior y la estabilidad o inestabilidad de los compuestos forman parte de la nomenclatura química.
1 Aprenda cómo se nombran los compuestos. La química tiene sus propias reglas para la nomenclatura. Los tipos de reacciones que suceden a los compuestos químicos, la pérdida o ganancia de electrones en su capa exterior y la estabilidad o inestabilidad de los compuestos forman parte de la nomenclatura química. -
 2 Toma la sección de la nomenclatura en serio. La mayoría de las clases de química inicial tienen una sección dedicada solo a la nomenclatura. En algunas escuelas, no pasar la nomenclatura como parte de la clase significa no aprobar la clase.
2 Toma la sección de la nomenclatura en serio. La mayoría de las clases de química inicial tienen una sección dedicada solo a la nomenclatura. En algunas escuelas, no pasar la nomenclatura como parte de la clase significa no aprobar la clase. - Si es posible, trabaje en la nomenclatura antes de comenzar realmente la clase. Muchos libros de trabajo están disponibles para la compra o a través de acceso en línea.
-
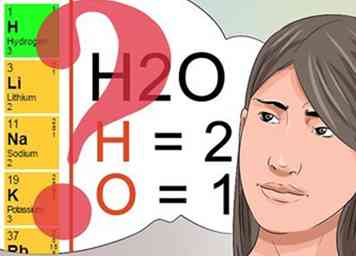 3 Sepa qué indican los números superíndices y subíndices. Comprender qué significan los números de superíndice y subíndice será fundamental para aprobar su clase de química.[24]
3 Sepa qué indican los números superíndices y subíndices. Comprender qué significan los números de superíndice y subíndice será fundamental para aprobar su clase de química.[24] - Los números superíndices siguen un patrón que se encuentra en la tabla periódica e indican la carga total del elemento o compuesto químico. Revise la tabla periódica para ver los elementos en filas verticales que comparten los mismos números superíndices.
- Los números de subíndice se usan para identificar la cantidad de cada elemento identificado que es parte del compuesto químico. Como se discutió anteriormente, el subíndice de 2 en la molécula H2O te dice que hay 2 átomos de hidrógeno como parte de esa molécula.
-
 4 Reconocer cómo los átomos reaccionan entre sí. Parte de la nomenclatura utilizada en química implica reglas específicas para nombrar los productos de tipos específicos de reacciones.[25]
4 Reconocer cómo los átomos reaccionan entre sí. Parte de la nomenclatura utilizada en química implica reglas específicas para nombrar los productos de tipos específicos de reacciones.[25] - Una de esas reacciones es la reacción de reducción oxidativa. Esta reacción implica el proceso de ganar o perder electrones.
- Una manera fácil de recordar el proceso es recordar la frase "LEO, el león dice GER". Esto significa perder electrones en la oxidación y ganar electrones en la reducción.[26]
-
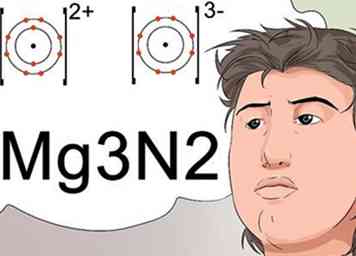 5 Reconozca que los subíndices pueden indicar la fórmula para una carga estable a un compuesto. Los científicos usan subíndices para identificar la fórmula molecular final de un compuesto, que también indica un compuesto estable con una carga neutra.
5 Reconozca que los subíndices pueden indicar la fórmula para una carga estable a un compuesto. Los científicos usan subíndices para identificar la fórmula molecular final de un compuesto, que también indica un compuesto estable con una carga neutra. - Para hacer una carga neutra, el ion de carga positiva, llamado catión, debe equilibrarse con una carga igual de un ion negativo, llamado anión. Los cargos se identifican como superíndices.[27]
- Por ejemplo, el ion magnesio tiene una carga de catión de +2 y el ion de nitrógeno tiene una carga de anión de -3. El +2 y el -3 se indicarán como superíndices. Para combinar adecuadamente los dos elementos para llegar a una carga neutra, se utilizan 3 átomos de magnesio por cada 2 elementos de nitrógeno.[28]
- La nomenclatura que identifica esto usa subíndices, y está escrito como Mg3N2.[29]
-
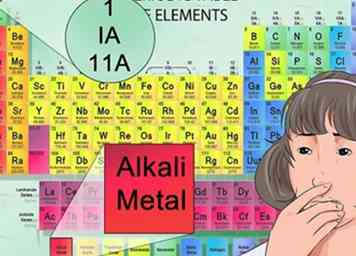
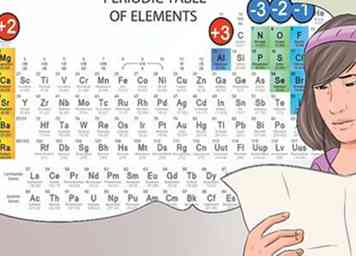 6 Identifica aniones y cationes desde su posición en la tabla periódica. Los elementos de la tabla periódica que se encuentran en la primera columna de elementos se consideran alcalinos y forman cargos de catión +1. Por ejemplo, Na + y Li +.[30]
6 Identifica aniones y cationes desde su posición en la tabla periódica. Los elementos de la tabla periódica que se encuentran en la primera columna de elementos se consideran alcalinos y forman cargos de catión +1. Por ejemplo, Na + y Li +.[30] - Los metales alcalinotérreos que se encuentran en la segunda columna forman 2+ cationes, como Mg2 + y Ba2 +.[31]
- Los elementos en la séptima columna se llaman halógenos y forman aniones -1, como Cl- e I-.[32]
-
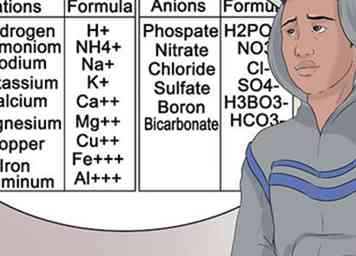 7 Aprenda a reconocer los aniones y cationes más comunes. Para ayudarlo a pasar su clase de química, sea lo más familiar posible con la nomenclatura adjunta a grupos de elementos. Este tipo de superíndice no cambia.[33]
7 Aprenda a reconocer los aniones y cationes más comunes. Para ayudarlo a pasar su clase de química, sea lo más familiar posible con la nomenclatura adjunta a grupos de elementos. Este tipo de superíndice no cambia.[33] - En otras palabras, el magnesio siempre se representa como Mg, y siempre tiene una carga de catión de +2.[34]
-
 8 Piense en la química como si aprendiera un nuevo idioma. Comprenda que las formas escritas de las cargas indicadas, el número de átomos en una molécula y los enlaces formados para mantener unidas las moléculas forman parte del lenguaje de la química. Todo esto es una forma escrita de representar lo que sucede en las reacciones químicas que realmente no se pueden ver.
8 Piense en la química como si aprendiera un nuevo idioma. Comprenda que las formas escritas de las cargas indicadas, el número de átomos en una molécula y los enlaces formados para mantener unidas las moléculas forman parte del lenguaje de la química. Todo esto es una forma escrita de representar lo que sucede en las reacciones químicas que realmente no se pueden ver. - Sería mucho más fácil entender si todo estaba visible, justo frente a ti. Pero además de comprender toda la química que está sucediendo, también debe comprender el lenguaje utilizado para registrar y representar todo lo relacionado con la química.
- Si comprender la química es difícil para ti, date cuenta de que no estás solo, pero no dejes que te gane. Hable con su profesor, su grupo de estudio, un asistente de enseñanza o alguien que sea realmente bueno en química. Puedes aprender todo esto, pero puede ser útil si se puede explicar de una manera que tenga sentido para ti.
Parte seis de ocho:
Haciendo las Matemáticas
-
 1 Conozca la secuencia de cálculos matemáticos básicos. En química, a veces se necesitan cálculos muy detallados, pero otras veces, solo las habilidades básicas de matemáticas son adecuadas. Es importante comprender la secuencia adecuada para completar los cálculos en una ecuación.[35]
1 Conozca la secuencia de cálculos matemáticos básicos. En química, a veces se necesitan cálculos muy detallados, pero otras veces, solo las habilidades básicas de matemáticas son adecuadas. Es importante comprender la secuencia adecuada para completar los cálculos en una ecuación.[35] - Memoriza una frase útil. La frase "disculpe a mi querida tía Sally" le dice qué aplicaciones debe realizar primero. La primera letra de cada palabra indica el orden que se utilizará.Cualquier cosa entre paréntesis se hace primero, luego exponenciación, multiplicación o división, la última suma o resta.
- Complete el cálculo 3 + 2 x 6 = ___, ordenando sus pasos según la frase. La respuesta a la ecuación es 15.
-
 2 Siéntete cómodo redondeando números muy grandes. Si bien redondear números no es exclusivo de la química, las respuestas a algunas de las complejas ecuaciones matemáticas resultan en números que son demasiado largos para escribir. Preste mucha atención a las instrucciones proporcionadas al redondear sus respuestas.[36]
2 Siéntete cómodo redondeando números muy grandes. Si bien redondear números no es exclusivo de la química, las respuestas a algunas de las complejas ecuaciones matemáticas resultan en números que son demasiado largos para escribir. Preste mucha atención a las instrucciones proporcionadas al redondear sus respuestas.[36] - Sepa dónde redondear hacia arriba o hacia abajo. Si el dígito siguiente en la serie es un 4 o menos, luego redondee hacia abajo, y si es un redondeo de 5 o más. Por ejemplo, considere el número 6.66666666666666. Se le pide que redondee su respuesta al segundo decimal. La respuesta es 6.67.[37]
-
 3 Comprender el valor absoluto. En química, algunos números se conocen como valor absoluto, y no su valor matemático real. El valor absoluto es la distancia desde el número a cero.
3 Comprender el valor absoluto. En química, algunos números se conocen como valor absoluto, y no su valor matemático real. El valor absoluto es la distancia desde el número a cero. - En otras palabras, ya no se consideran positivos o negativos, solo la distancia a cero. Por ejemplo, el valor absoluto de -20 es 20.[38]
-
 4 Familiarícese con las unidades de medida aceptadas. Aquí están algunos ejemplos.
4 Familiarícese con las unidades de medida aceptadas. Aquí están algunos ejemplos. - Las medidas de la materia se expresan en moles (mol).
- La temperatura se expresa en grados Fahrenheit (° F), Kelvin (° K) o Celsius (° C).
- La masa se expresa en gramos (g), kilogramos (kg) o miligramos (mg).
- Las medidas líquidas se expresan en litros (L) o mililitros (ml).
-
 5 Practique la conversión de una escala de medida a otra. Parte de pasar su clase de química implicará realizar conversiones de una escala aceptada a otra. Esto puede incluir el cambio de una medición de temperatura a otra, cambio de libras a kilogramos y de onzas a litros.
5 Practique la conversión de una escala de medida a otra. Parte de pasar su clase de química implicará realizar conversiones de una escala aceptada a otra. Esto puede incluir el cambio de una medición de temperatura a otra, cambio de libras a kilogramos y de onzas a litros. - Es posible que se le solicite que proporcione respuestas en unidades distintas de las que estaban en la pregunta original. Por ejemplo, se le puede dar una ecuación de temperatura para resolver en Celsius, y se le pide que dé la respuesta final en Kelvin.
- Kelvin es el estándar internacional para las mediciones de temperatura que a menudo se usan en reacciones químicas. Practica cambiando de grados Celsius a grados Kelvin o Fahrenheit.
-
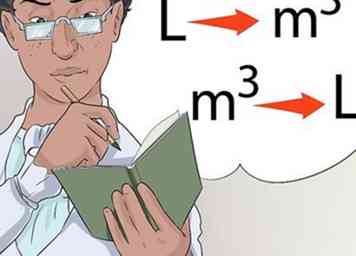 6 Tómese el tiempo para practicar. A medida que esté expuesto a varias conversiones en su clase, tómese el tiempo para aprender a convertir de una a la otra, y viceversa.
6 Tómese el tiempo para practicar. A medida que esté expuesto a varias conversiones en su clase, tómese el tiempo para aprender a convertir de una a la otra, y viceversa. -
 7 Sepa cómo calcular las concentraciones. Afila tus habilidades matemáticas básicas en las áreas de porcentajes, proporciones y proporciones.
7 Sepa cómo calcular las concentraciones. Afila tus habilidades matemáticas básicas en las áreas de porcentajes, proporciones y proporciones. -
 8 Practica con etiquetas de nutrición en productos alimenticios. Para aprobar la química, deberá sentirse cómodo al calcular proporciones, porcentajes y luego de nuevo. Si esto es difícil para usted, practique el uso de otras unidades de medida comunes, como las que se encuentran en las etiquetas de los alimentos.
8 Practica con etiquetas de nutrición en productos alimenticios. Para aprobar la química, deberá sentirse cómodo al calcular proporciones, porcentajes y luego de nuevo. Si esto es difícil para usted, practique el uso de otras unidades de medida comunes, como las que se encuentran en las etiquetas de los alimentos. - Mire la etiqueta de nutrición en cualquier producto alimenticio. Verá calorías por porción, porcentaje de RDA, grasa total, calorías de grasa, carbohidratos totales y un desglose de los diferentes tipos de carbohidratos. Practique calculando diferentes proporciones y proporciones usando diferentes categorías para el número inferior.
- Por ejemplo, calcule la cantidad de grasa monoinsaturada por la cantidad total de grasa. Cambie esto a un porcentaje. Calcule cuántas calorías hay en todo el contenedor usando los números proporcionados para calorías por porción y porciones por contenedor. Calcule la cantidad de sodio contenida en la mitad del contenedor lleno.
- Al practicar conversiones como esta, independientemente de las unidades utilizadas, se sentirá mucho más cómodo intercambiando estas unidades de medida por medidas químicas, como moles por litro o gramos por ml, etc.
-
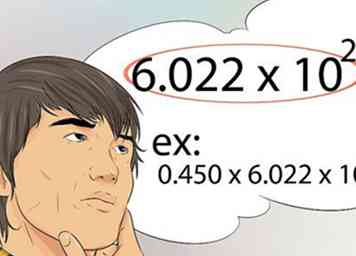 9 Sepa cómo usar el número de Avogadro. Este es el número que representa la cantidad de moléculas, átomos o partículas que se encuentran en un mol. El número de Avogrado es 6.022x10 23.[39]
9 Sepa cómo usar el número de Avogadro. Este es el número que representa la cantidad de moléculas, átomos o partículas que se encuentran en un mol. El número de Avogrado es 6.022x10 23.[39] - Por ejemplo, 0.450 moles de Fe contiene cuántos átomos? La respuesta es 0.450 x 6.022x10 23.[40]
-
 10 Piensa en las zanahorias. Si tiene problemas para entender cómo aplicar el número de Avogadro, piense en términos de zanahorias en lugar de átomos, moléculas o partículas. ¿Cuántas zanahorias hay en una docena? Bueno, sabes que una docena contiene 12 de algo, por lo que hay 12 zanahorias en una docena.
10 Piensa en las zanahorias. Si tiene problemas para entender cómo aplicar el número de Avogadro, piense en términos de zanahorias en lugar de átomos, moléculas o partículas. ¿Cuántas zanahorias hay en una docena? Bueno, sabes que una docena contiene 12 de algo, por lo que hay 12 zanahorias en una docena. - Ahora responde la pregunta: ¿Cuántas zanahorias hay en un lunar? En lugar de multiplicar por 12, multiplique usando el número de Avogadro. Entonces, hay 6,022 x 1023 zanahorias en un mol.
- El número de Avogadro se usa para convertir cualquier cosa de sustancia, un átomo, molécula, partícula o zanahoria, en la cantidad de esa cosa que está contenida en un mol.
- Si conoce la cantidad de moles de algo, entonces el valor final para la cantidad de moléculas, átomos o partículas presentes es ese número multiplicado por el número de Avogrado.[41]
- Comprender cómo convertir partículas en topos es una parte importante de la química de aprobación. Las conversiones molares son una parte del cálculo de proporciones y proporciones. Esto significa la cantidad de algo en moles como parte de otra cosa.
-
 11 Concéntrese en comprender la Molaridad. Considere la cantidad de moles de algo contenido en un ambiente líquido. Este ejemplo es importante de entender, ya que ahora estamos hablando de Molaridad, o la proporción de algo expresado como moles por litro.
11 Concéntrese en comprender la Molaridad. Considere la cantidad de moles de algo contenido en un ambiente líquido. Este ejemplo es importante de entender, ya que ahora estamos hablando de Molaridad, o la proporción de algo expresado como moles por litro. - La molaridad se usa comúnmente en química para expresar la cantidad de algo en un entorno líquido, o la cantidad de un soluto contenido en una solución líquida. La molaridad se calcula dividiendo los moles de soluto por los litros de solución. La molaridad se expresa como moles por litro.[42]
- Calcula la densidad La densidad también es una medida comúnmente utilizada en química. La densidad es la medida de la masa por unidad de volumen de una sustancia química. La expresión más común para la densidad se da en gramos por mililitro, o gramos por centímetro cúbico, que son la misma cosa.[43]
-
 12 Convierte ecuaciones a su fórmula empírica. Esto significa que las respuestas finales para las ecuaciones se considerarán incorrectas a menos que las haya desglosado en su forma más simple.[44]
12 Convierte ecuaciones a su fórmula empírica. Esto significa que las respuestas finales para las ecuaciones se considerarán incorrectas a menos que las haya desglosado en su forma más simple.[44] - Esto no se aplica a las fórmulas moleculares ya que ese tipo de descripción te dice las proporciones exactas de los elementos químicos que componen la molécula.[45]
-
 13 Saber qué está incluido en una fórmula molecular. No cambias una fórmula molecular a su forma más simple o empírica porque la fórmula molecular te dice exactamente qué compone la molécula.
13 Saber qué está incluido en una fórmula molecular. No cambias una fórmula molecular a su forma más simple o empírica porque la fórmula molecular te dice exactamente qué compone la molécula. - Una fórmula molecular está escrita en un lenguaje que usa la abreviación de los elementos y cuántos átomos de cada elemento componen la molécula.
- Por ejemplo, la fórmula molecular del agua es H2O. Esto significa que cada molécula de agua contiene 2 átomos de hidrógeno y 1 átomo de oxígeno. La fórmula molecular para el paracetamol es C8H9NO2. Cada compuesto químico está representado por su fórmula molecular.
-
 14 Considere las matemáticas de la química como estequiometría. Es probable que te encuentres con este término. Es una descripción de la forma en que la química se expresa utilizando fórmulas matemáticas. Usando la matemática química, o estequiometría, los valores de los elementos y los compuestos químicos a menudo se representan en términos de moles, porcentaje molar, moles por litro o moles por kg.[46]
14 Considere las matemáticas de la química como estequiometría. Es probable que te encuentres con este término. Es una descripción de la forma en que la química se expresa utilizando fórmulas matemáticas. Usando la matemática química, o estequiometría, los valores de los elementos y los compuestos químicos a menudo se representan en términos de moles, porcentaje molar, moles por litro o moles por kg.[46] - Como procedimiento matemático común, deberá convertir gramos en moles. La unidad de masa atómica de un elemento, en gramos, es igual a un mol de esa sustancia. Por ejemplo, el calcio tiene una masa de 40 unidades de masa atómica. Por lo tanto, 40 gramos de calcio equivalen a un mol de calcio.[47]
-
 15 Pide ejemplos adicionales. Si las ecuaciones matemáticas y las conversiones no le son fáciles, hable con su maestro o profesor. Solicite más problemas para que pueda trabajar por su cuenta, hasta que los conceptos involucrados y todos los factores de conversión tengan sentido para usted.
15 Pide ejemplos adicionales. Si las ecuaciones matemáticas y las conversiones no le son fáciles, hable con su maestro o profesor. Solicite más problemas para que pueda trabajar por su cuenta, hasta que los conceptos involucrados y todos los factores de conversión tengan sentido para usted.
Parte Siete de Ocho:
Desarrollar buenos hábitos de estudio
-
 1 Forma o únete a un grupo de estudio. No se avergüence si la química es difícil para usted. Es un tema difícil para casi todos.
1 Forma o únete a un grupo de estudio. No se avergüence si la química es difícil para usted. Es un tema difícil para casi todos. - Al trabajar en grupos, algunos miembros encontrarán áreas más fáciles que otras, y pueden ayudar a compartir sus métodos de aprendizaje con el grupo. Divide y conquistaras.
-
 2 Lee todos los capítulos en tu libro de texto de química. Leer un libro de química no siempre es el libro más interesante del estante. Pero tómese el tiempo para leer las secciones asignadas y resalte las partes que simplemente no parecen tener sentido. Intente hacer una lista de preguntas o conceptos que tenga problemas para entender.
2 Lee todos los capítulos en tu libro de texto de química. Leer un libro de química no siempre es el libro más interesante del estante. Pero tómese el tiempo para leer las secciones asignadas y resalte las partes que simplemente no parecen tener sentido. Intente hacer una lista de preguntas o conceptos que tenga problemas para entender. - Regrese a esas partes más tarde y tome una nueva mirada. Si todavía les parece confuso, hablen con su grupo de estudio, su profesor o un asistente de enseñanza.
- Intenta responder las preguntas al final del capítulo. La mayoría de los libros de texto brindan información adicional que explica las respuestas correctas en caso de que algo sea confuso para usted.
- Los libros de texto usan ayudas visuales para transmitir los principales puntos de enseñanza. Mire las imágenes y preste atención a los subtítulos. Esto puede ayudar a despejar la confusión.
-
 3 Pide permiso para grabar las conferencias. Tomar notas y mirar todo lo que el maestro escribe en tableros o transparencias es difícil de hacer, especialmente en una materia difícil como la química. Tener una grabación que pueda escuchar una y otra vez puede ayudar a que le sea más fácil de entender. Sin embargo, siempre debe pedir permiso para grabar las conferencias antes de hacerlo.
3 Pide permiso para grabar las conferencias. Tomar notas y mirar todo lo que el maestro escribe en tableros o transparencias es difícil de hacer, especialmente en una materia difícil como la química. Tener una grabación que pueda escuchar una y otra vez puede ayudar a que le sea más fácil de entender. Sin embargo, siempre debe pedir permiso para grabar las conferencias antes de hacerlo. - Intente decir algo así como: "Me resulta más fácil estudiar si puedo escuchar la conferencia una vez más mientras reviso mis notas. ¿Estaría bien si grabo tus conferencias para poder hacer eso? "
-
 4 Accede a pruebas antiguas o guías de estudio. La mayoría de los cursos de ciencias naturales, como la química, brindan acceso a preguntas de exámenes anteriores para ayudar a los estudiantes a prepararse para los exámenes principales.
4 Accede a pruebas antiguas o guías de estudio. La mayoría de los cursos de ciencias naturales, como la química, brindan acceso a preguntas de exámenes anteriores para ayudar a los estudiantes a prepararse para los exámenes principales. - Evite simplemente memorizar las respuestas. La química es un tema que debes entender para responder a la misma pregunta si se redactó de otra manera.
Parte ocho de ocho:
Obteniendo ayuda
-
 1 Conozca a su profesor o maestro. Para aprobar la química con la mejor calificación posible, tómese el tiempo para conocer a la persona que enseña la clase. Si estás luchando, hazles saber que esto es difícil para ti. Sin embargo, incluso si te está yendo bien, es una gran idea conocer al profesor.
1 Conozca a su profesor o maestro. Para aprobar la química con la mejor calificación posible, tómese el tiempo para conocer a la persona que enseña la clase. Si estás luchando, hazles saber que esto es difícil para ti. Sin embargo, incluso si te está yendo bien, es una gran idea conocer al profesor. - Muchos profesores tienen guías de estudio disponibles y abren horarios de oficina adicionales para ayudar a los estudiantes cuando sea necesario.
- Mantenga una lista de las áreas que son difíciles y pídale ayuda a su profesor o maestro. Esto le brinda la oportunidad de comprender los temas difíciles antes de que la clase pase a la siguiente sección y se confunde aún más.
-
 2 Visite los recursos de ayuda en línea. Preste atención a todos los recursos en línea o enlaces proporcionados por el departamento de química de su propia escuela.
2 Visite los recursos de ayuda en línea. Preste atención a todos los recursos en línea o enlaces proporcionados por el departamento de química de su propia escuela. -
 3 Intenta no abrumarte. La información detallada sobre los diferentes tipos de reacciones químicas, el intercambio de electrones, el cambio de la carga de un elemento o compuesto, y saber qué hacen los diferentes tipos de reacciones, puede ser muy confuso.
3 Intenta no abrumarte. La información detallada sobre los diferentes tipos de reacciones químicas, el intercambio de electrones, el cambio de la carga de un elemento o compuesto, y saber qué hacen los diferentes tipos de reacciones, puede ser muy confuso. - Analice las áreas que son difíciles en términos descriptibles. Por ejemplo, sea capaz de verbalizar que no comprende las reacciones de oxidación, o cómo combinar elementos con cargas positivas y negativas. Al verbalizar las áreas que tiene dificultades para comprender, también puede encontrar algo de seguridad al darse cuenta de que hay mucho que ha aprendido y que comprende.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Comience con la estructura más básica. Para aprobar tu clase de química, necesitarás tener una buena comprensión de los elementos básicos que componen todo lo que tiene sustancia o masa.
1 Comience con la estructura más básica. Para aprobar tu clase de química, necesitarás tener una buena comprensión de los elementos básicos que componen todo lo que tiene sustancia o masa.  2 Comprende el concepto de un átomo. Un átomo se considera el bloque de construcción más pequeño de todo lo que tiene masa, incluidas las cosas que no siempre podemos ver, como los gases. Pero incluso el pequeño átomo tiene partes aún más pequeñas que conforman su estructura.[1]
2 Comprende el concepto de un átomo. Un átomo se considera el bloque de construcción más pequeño de todo lo que tiene masa, incluidas las cosas que no siempre podemos ver, como los gases. Pero incluso el pequeño átomo tiene partes aún más pequeñas que conforman su estructura.[1]  3 Comprender el marco atómico de un elemento. Se considera que un elemento es una sustancia en la naturaleza que no puede descomponerse en ningún otro elemento (s) ni en ninguna otra forma más simple. Los elementos están hechos de átomos.[4]
3 Comprender el marco atómico de un elemento. Se considera que un elemento es una sustancia en la naturaleza que no puede descomponerse en ningún otro elemento (s) ni en ninguna otra forma más simple. Los elementos están hechos de átomos.[4]  4 Comprende más sobre el núcleo. Los neutrones, que se encuentran en el núcleo, son neutrales a cargo. Los protones tienen una carga positiva. El número atómico de un elemento es exactamente el mismo que el número de protones contenidos en el núcleo.[6]
4 Comprende más sobre el núcleo. Los neutrones, que se encuentran en el núcleo, son neutrales a cargo. Los protones tienen una carga positiva. El número atómico de un elemento es exactamente el mismo que el número de protones contenidos en el núcleo.[6]  5 Reconoce los diagramas de Lewis. Los diagramas de Lewis a veces se llaman diagramas de electrones. Estos son diagramas simples que usan puntos para representar los electrones apareados y no apareados en la capa externa de un átomo.[7]
5 Reconoce los diagramas de Lewis. Los diagramas de Lewis a veces se llaman diagramas de electrones. Estos son diagramas simples que usan puntos para representar los electrones apareados y no apareados en la capa externa de un átomo.[7]  6 Sepa lo que significa la regla del octeto. Los diagramas de Lewis operan en la regla del octeto, que establece que los átomos son estables cuando tiene acceso a ocho electrones en la capa externa. El hidrógeno es la excepción, y se considera estable con dos electrones en la capa exterior.[9]
6 Sepa lo que significa la regla del octeto. Los diagramas de Lewis operan en la regla del octeto, que establece que los átomos son estables cuando tiene acceso a ocho electrones en la capa externa. El hidrógeno es la excepción, y se considera estable con dos electrones en la capa exterior.[9]  7 Dibuja un diagrama de Lewis. El símbolo de un elemento, rodeado por una disposición de puntos, es un diagrama de Lewis. Piense en el diagrama como un fotograma fijo de una película. En lugar de que los electrones se arremolinen alrededor del exterior del elemento, se representan como un momento fijo en el tiempo.[10]
7 Dibuja un diagrama de Lewis. El símbolo de un elemento, rodeado por una disposición de puntos, es un diagrama de Lewis. Piense en el diagrama como un fotograma fijo de una película. En lugar de que los electrones se arremolinen alrededor del exterior del elemento, se representan como un momento fijo en el tiempo.[10]  8 Comprenda la disposición de los electrones a medida que unen los elementos. Los diagramas de Lewis son una representación visual simplista de lo que se entiende acerca de los enlaces químicos.
8 Comprenda la disposición de los electrones a medida que unen los elementos. Los diagramas de Lewis son una representación visual simplista de lo que se entiende acerca de los enlaces químicos.  1 Mira la tabla periódica. Si tiene problemas con las propiedades de los elementos, dedique un tiempo a revisar cualquier material disponible en la tabla periódica. Lo más importante, mira de cerca a uno.
1 Mira la tabla periódica. Si tiene problemas con las propiedades de los elementos, dedique un tiempo a revisar cualquier material disponible en la tabla periódica. Lo más importante, mira de cerca a uno.  4 Encuentra la masa atómica de cada elemento. El número en la parte inferior es la masa atómica. Recuerde, la cantidad de protones combinados con la cantidad de neutrones que se encuentran en el núcleo es igual al número de masa atómica.[14]
4 Encuentra la masa atómica de cada elemento. El número en la parte inferior es la masa atómica. Recuerde, la cantidad de protones combinados con la cantidad de neutrones que se encuentran en el núcleo es igual al número de masa atómica.[14]  5 Calcule la cantidad de neutrones que se encuentran en el núcleo. Puede usar los números provistos en la tabla periódica para resolver esto. El número atómico para cualquier elemento es exactamente el mismo que el número de protones encontrados en el núcleo.
5 Calcule la cantidad de neutrones que se encuentran en el núcleo. Puede usar los números provistos en la tabla periódica para resolver esto. El número atómico para cualquier elemento es exactamente el mismo que el número de protones encontrados en el núcleo.  6 Calcula la cantidad de electrones. Recuerde que los opuestos se atraen. Los electrones son partículas con carga positiva que vuelan alrededor del núcleo de un átomo, como los planetas que giran alrededor del sol. La cantidad de electrones cargados negativamente que se extraen hacia el núcleo depende del número de protones cargados positivamente ubicados en el núcleo.
6 Calcula la cantidad de electrones. Recuerde que los opuestos se atraen. Los electrones son partículas con carga positiva que vuelan alrededor del núcleo de un átomo, como los planetas que giran alrededor del sol. La cantidad de electrones cargados negativamente que se extraen hacia el núcleo depende del número de protones cargados positivamente ubicados en el núcleo.  1 Balancee una ecuación química. En una clase de química, se espera que sepas cómo predecir lo que sucederá cuando los elementos se combinen. En papel, esto se llama equilibrar ecuaciones químicas.[17]
1 Balancee una ecuación química. En una clase de química, se espera que sepas cómo predecir lo que sucederá cuando los elementos se combinen. En papel, esto se llama equilibrar ecuaciones químicas.[17]  2 Piensa en las ecuaciones de manera diferente. Si tiene problemas para equilibrar las ecuaciones químicas, piense en la ecuación como parte de una receta, pero una que necesite ajustarse en ambos lados, para que pueda obtener más de menos de su receta.
2 Piensa en las ecuaciones de manera diferente. Si tiene problemas para equilibrar las ecuaciones químicas, piense en la ecuación como parte de una receta, pero una que necesite ajustarse en ambos lados, para que pueda obtener más de menos de su receta. 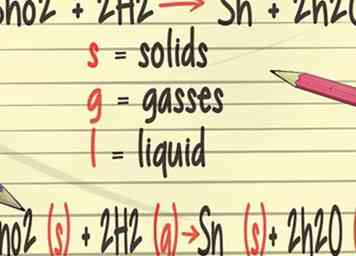 3 Agregue más detalles a sus ecuaciones equilibradas. En tu clase de química, aprenderás a agregar símbolos a tus ecuaciones equilibradas que representan el estado físico de los elementos. Estos símbolos incluirán (s) para sólidos, (g) para gases y (l) para líquidos.[21]
3 Agregue más detalles a sus ecuaciones equilibradas. En tu clase de química, aprenderás a agregar símbolos a tus ecuaciones equilibradas que representan el estado físico de los elementos. Estos símbolos incluirán (s) para sólidos, (g) para gases y (l) para líquidos.[21]  4 Identifica los cambios que ocurren en una reacción química. Las reacciones químicas comienzan con los elementos básicos, o elementos ya combinados, llamados reactivos. La combinación de dos o más reactivos en conjunto da como resultado un solo producto o varios productos.
4 Identifica los cambios que ocurren en una reacción química. Las reacciones químicas comienzan con los elementos básicos, o elementos ya combinados, llamados reactivos. La combinación de dos o más reactivos en conjunto da como resultado un solo producto o varios productos.  1 Reconoce los tipos de reacciones. Las reacciones químicas pueden ocurrir como resultado de muchas influencias, además de simplemente combinar ingredientes.
1 Reconoce los tipos de reacciones. Las reacciones químicas pueden ocurrir como resultado de muchas influencias, además de simplemente combinar ingredientes.  2 Use los recursos provistos. Deberá comprender las diferencias en cada tipo de reacción abarcada en su clase. Use los recursos puestos a su disposición por su profesor o profesor para comprender los diferentes tipos de reacciones cubiertas en su clase. No tengas miedo de hacer preguntas.
2 Use los recursos provistos. Deberá comprender las diferencias en cada tipo de reacción abarcada en su clase. Use los recursos puestos a su disposición por su profesor o profesor para comprender los diferentes tipos de reacciones cubiertas en su clase. No tengas miedo de hacer preguntas.  3 Piensa en las reacciones químicas lógicamente. Trate de no hacer que sea más difícil de lo que ya es al quedar atrapado en la terminología.Los tipos de reacciones químicas que aprenderá simplemente implican hacer algo para cambiar algo.
3 Piensa en las reacciones químicas lógicamente. Trate de no hacer que sea más difícil de lo que ya es al quedar atrapado en la terminología.Los tipos de reacciones químicas que aprenderá simplemente implican hacer algo para cambiar algo.  1 Aprenda cómo se nombran los compuestos. La química tiene sus propias reglas para la nomenclatura. Los tipos de reacciones que suceden a los compuestos químicos, la pérdida o ganancia de electrones en su capa exterior y la estabilidad o inestabilidad de los compuestos forman parte de la nomenclatura química.
1 Aprenda cómo se nombran los compuestos. La química tiene sus propias reglas para la nomenclatura. Los tipos de reacciones que suceden a los compuestos químicos, la pérdida o ganancia de electrones en su capa exterior y la estabilidad o inestabilidad de los compuestos forman parte de la nomenclatura química.  2 Toma la sección de la nomenclatura en serio. La mayoría de las clases de química inicial tienen una sección dedicada solo a la nomenclatura. En algunas escuelas, no pasar la nomenclatura como parte de la clase significa no aprobar la clase.
2 Toma la sección de la nomenclatura en serio. La mayoría de las clases de química inicial tienen una sección dedicada solo a la nomenclatura. En algunas escuelas, no pasar la nomenclatura como parte de la clase significa no aprobar la clase. 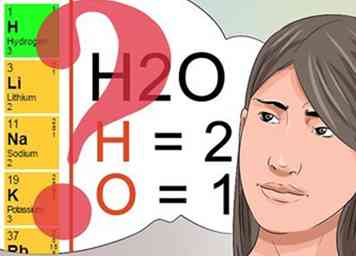 3 Sepa qué indican los números superíndices y subíndices. Comprender qué significan los números de superíndice y subíndice será fundamental para aprobar su clase de química.[24]
3 Sepa qué indican los números superíndices y subíndices. Comprender qué significan los números de superíndice y subíndice será fundamental para aprobar su clase de química.[24]  4 Reconocer cómo los átomos reaccionan entre sí. Parte de la nomenclatura utilizada en química implica reglas específicas para nombrar los productos de tipos específicos de reacciones.[25]
4 Reconocer cómo los átomos reaccionan entre sí. Parte de la nomenclatura utilizada en química implica reglas específicas para nombrar los productos de tipos específicos de reacciones.[25]  5 Reconozca que los subíndices pueden indicar la fórmula para una carga estable a un compuesto. Los científicos usan subíndices para identificar la fórmula molecular final de un compuesto, que también indica un compuesto estable con una carga neutra.
5 Reconozca que los subíndices pueden indicar la fórmula para una carga estable a un compuesto. Los científicos usan subíndices para identificar la fórmula molecular final de un compuesto, que también indica un compuesto estable con una carga neutra.  6 Identifica aniones y cationes desde su posición en la tabla periódica. Los elementos de la tabla periódica que se encuentran en la primera columna de elementos se consideran alcalinos y forman cargos de catión +1. Por ejemplo, Na + y Li +.[30]
6 Identifica aniones y cationes desde su posición en la tabla periódica. Los elementos de la tabla periódica que se encuentran en la primera columna de elementos se consideran alcalinos y forman cargos de catión +1. Por ejemplo, Na + y Li +.[30]  7 Aprenda a reconocer los aniones y cationes más comunes. Para ayudarlo a pasar su clase de química, sea lo más familiar posible con la nomenclatura adjunta a grupos de elementos. Este tipo de superíndice no cambia.[33]
7 Aprenda a reconocer los aniones y cationes más comunes. Para ayudarlo a pasar su clase de química, sea lo más familiar posible con la nomenclatura adjunta a grupos de elementos. Este tipo de superíndice no cambia.[33]  8 Piense en la química como si aprendiera un nuevo idioma. Comprenda que las formas escritas de las cargas indicadas, el número de átomos en una molécula y los enlaces formados para mantener unidas las moléculas forman parte del lenguaje de la química. Todo esto es una forma escrita de representar lo que sucede en las reacciones químicas que realmente no se pueden ver.
8 Piense en la química como si aprendiera un nuevo idioma. Comprenda que las formas escritas de las cargas indicadas, el número de átomos en una molécula y los enlaces formados para mantener unidas las moléculas forman parte del lenguaje de la química. Todo esto es una forma escrita de representar lo que sucede en las reacciones químicas que realmente no se pueden ver.  1 Conozca la secuencia de cálculos matemáticos básicos. En química, a veces se necesitan cálculos muy detallados, pero otras veces, solo las habilidades básicas de matemáticas son adecuadas. Es importante comprender la secuencia adecuada para completar los cálculos en una ecuación.[35]
1 Conozca la secuencia de cálculos matemáticos básicos. En química, a veces se necesitan cálculos muy detallados, pero otras veces, solo las habilidades básicas de matemáticas son adecuadas. Es importante comprender la secuencia adecuada para completar los cálculos en una ecuación.[35]  2 Siéntete cómodo redondeando números muy grandes. Si bien redondear números no es exclusivo de la química, las respuestas a algunas de las complejas ecuaciones matemáticas resultan en números que son demasiado largos para escribir. Preste mucha atención a las instrucciones proporcionadas al redondear sus respuestas.[36]
2 Siéntete cómodo redondeando números muy grandes. Si bien redondear números no es exclusivo de la química, las respuestas a algunas de las complejas ecuaciones matemáticas resultan en números que son demasiado largos para escribir. Preste mucha atención a las instrucciones proporcionadas al redondear sus respuestas.[36]  3 Comprender el valor absoluto. En química, algunos números se conocen como valor absoluto, y no su valor matemático real. El valor absoluto es la distancia desde el número a cero.
3 Comprender el valor absoluto. En química, algunos números se conocen como valor absoluto, y no su valor matemático real. El valor absoluto es la distancia desde el número a cero.  4 Familiarícese con las unidades de medida aceptadas. Aquí están algunos ejemplos.
4 Familiarícese con las unidades de medida aceptadas. Aquí están algunos ejemplos.  5 Practique la conversión de una escala de medida a otra. Parte de pasar su clase de química implicará realizar conversiones de una escala aceptada a otra. Esto puede incluir el cambio de una medición de temperatura a otra, cambio de libras a kilogramos y de onzas a litros.
5 Practique la conversión de una escala de medida a otra. Parte de pasar su clase de química implicará realizar conversiones de una escala aceptada a otra. Esto puede incluir el cambio de una medición de temperatura a otra, cambio de libras a kilogramos y de onzas a litros.  6 Tómese el tiempo para practicar. A medida que esté expuesto a varias conversiones en su clase, tómese el tiempo para aprender a convertir de una a la otra, y viceversa.
6 Tómese el tiempo para practicar. A medida que esté expuesto a varias conversiones en su clase, tómese el tiempo para aprender a convertir de una a la otra, y viceversa.  7 Sepa cómo calcular las concentraciones. Afila tus habilidades matemáticas básicas en las áreas de porcentajes, proporciones y proporciones.
7 Sepa cómo calcular las concentraciones. Afila tus habilidades matemáticas básicas en las áreas de porcentajes, proporciones y proporciones.  8 Practica con etiquetas de nutrición en productos alimenticios. Para aprobar la química, deberá sentirse cómodo al calcular proporciones, porcentajes y luego de nuevo. Si esto es difícil para usted, practique el uso de otras unidades de medida comunes, como las que se encuentran en las etiquetas de los alimentos.
8 Practica con etiquetas de nutrición en productos alimenticios. Para aprobar la química, deberá sentirse cómodo al calcular proporciones, porcentajes y luego de nuevo. Si esto es difícil para usted, practique el uso de otras unidades de medida comunes, como las que se encuentran en las etiquetas de los alimentos. 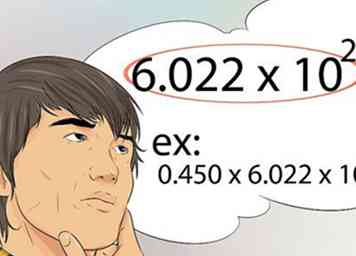 9 Sepa cómo usar el número de Avogadro. Este es el número que representa la cantidad de moléculas, átomos o partículas que se encuentran en un mol. El número de Avogrado es 6.022x10 23.[39]
9 Sepa cómo usar el número de Avogadro. Este es el número que representa la cantidad de moléculas, átomos o partículas que se encuentran en un mol. El número de Avogrado es 6.022x10 23.[39]  10 Piensa en las zanahorias. Si tiene problemas para entender cómo aplicar el número de Avogadro, piense en términos de zanahorias en lugar de átomos, moléculas o partículas. ¿Cuántas zanahorias hay en una docena? Bueno, sabes que una docena contiene 12 de algo, por lo que hay 12 zanahorias en una docena.
10 Piensa en las zanahorias. Si tiene problemas para entender cómo aplicar el número de Avogadro, piense en términos de zanahorias en lugar de átomos, moléculas o partículas. ¿Cuántas zanahorias hay en una docena? Bueno, sabes que una docena contiene 12 de algo, por lo que hay 12 zanahorias en una docena.  11 Concéntrese en comprender la Molaridad. Considere la cantidad de moles de algo contenido en un ambiente líquido. Este ejemplo es importante de entender, ya que ahora estamos hablando de Molaridad, o la proporción de algo expresado como moles por litro.
11 Concéntrese en comprender la Molaridad. Considere la cantidad de moles de algo contenido en un ambiente líquido. Este ejemplo es importante de entender, ya que ahora estamos hablando de Molaridad, o la proporción de algo expresado como moles por litro.  12 Convierte ecuaciones a su fórmula empírica. Esto significa que las respuestas finales para las ecuaciones se considerarán incorrectas a menos que las haya desglosado en su forma más simple.[44]
12 Convierte ecuaciones a su fórmula empírica. Esto significa que las respuestas finales para las ecuaciones se considerarán incorrectas a menos que las haya desglosado en su forma más simple.[44]  13 Saber qué está incluido en una fórmula molecular. No cambias una fórmula molecular a su forma más simple o empírica porque la fórmula molecular te dice exactamente qué compone la molécula.
13 Saber qué está incluido en una fórmula molecular. No cambias una fórmula molecular a su forma más simple o empírica porque la fórmula molecular te dice exactamente qué compone la molécula.  14 Considere las matemáticas de la química como estequiometría. Es probable que te encuentres con este término. Es una descripción de la forma en que la química se expresa utilizando fórmulas matemáticas. Usando la matemática química, o estequiometría, los valores de los elementos y los compuestos químicos a menudo se representan en términos de moles, porcentaje molar, moles por litro o moles por kg.[46]
14 Considere las matemáticas de la química como estequiometría. Es probable que te encuentres con este término. Es una descripción de la forma en que la química se expresa utilizando fórmulas matemáticas. Usando la matemática química, o estequiometría, los valores de los elementos y los compuestos químicos a menudo se representan en términos de moles, porcentaje molar, moles por litro o moles por kg.[46]  15 Pide ejemplos adicionales. Si las ecuaciones matemáticas y las conversiones no le son fáciles, hable con su maestro o profesor. Solicite más problemas para que pueda trabajar por su cuenta, hasta que los conceptos involucrados y todos los factores de conversión tengan sentido para usted.
15 Pide ejemplos adicionales. Si las ecuaciones matemáticas y las conversiones no le son fáciles, hable con su maestro o profesor. Solicite más problemas para que pueda trabajar por su cuenta, hasta que los conceptos involucrados y todos los factores de conversión tengan sentido para usted.  1 Forma o únete a un grupo de estudio. No se avergüence si la química es difícil para usted. Es un tema difícil para casi todos.
1 Forma o únete a un grupo de estudio. No se avergüence si la química es difícil para usted. Es un tema difícil para casi todos.  2 Lee todos los capítulos en tu libro de texto de química. Leer un libro de química no siempre es el libro más interesante del estante. Pero tómese el tiempo para leer las secciones asignadas y resalte las partes que simplemente no parecen tener sentido. Intente hacer una lista de preguntas o conceptos que tenga problemas para entender.
2 Lee todos los capítulos en tu libro de texto de química. Leer un libro de química no siempre es el libro más interesante del estante. Pero tómese el tiempo para leer las secciones asignadas y resalte las partes que simplemente no parecen tener sentido. Intente hacer una lista de preguntas o conceptos que tenga problemas para entender.  3 Pide permiso para grabar las conferencias. Tomar notas y mirar todo lo que el maestro escribe en tableros o transparencias es difícil de hacer, especialmente en una materia difícil como la química. Tener una grabación que pueda escuchar una y otra vez puede ayudar a que le sea más fácil de entender. Sin embargo, siempre debe pedir permiso para grabar las conferencias antes de hacerlo.
3 Pide permiso para grabar las conferencias. Tomar notas y mirar todo lo que el maestro escribe en tableros o transparencias es difícil de hacer, especialmente en una materia difícil como la química. Tener una grabación que pueda escuchar una y otra vez puede ayudar a que le sea más fácil de entender. Sin embargo, siempre debe pedir permiso para grabar las conferencias antes de hacerlo.  4 Accede a pruebas antiguas o guías de estudio. La mayoría de los cursos de ciencias naturales, como la química, brindan acceso a preguntas de exámenes anteriores para ayudar a los estudiantes a prepararse para los exámenes principales.
4 Accede a pruebas antiguas o guías de estudio. La mayoría de los cursos de ciencias naturales, como la química, brindan acceso a preguntas de exámenes anteriores para ayudar a los estudiantes a prepararse para los exámenes principales.  1 Conozca a su profesor o maestro. Para aprobar la química con la mejor calificación posible, tómese el tiempo para conocer a la persona que enseña la clase. Si estás luchando, hazles saber que esto es difícil para ti. Sin embargo, incluso si te está yendo bien, es una gran idea conocer al profesor.
1 Conozca a su profesor o maestro. Para aprobar la química con la mejor calificación posible, tómese el tiempo para conocer a la persona que enseña la clase. Si estás luchando, hazles saber que esto es difícil para ti. Sin embargo, incluso si te está yendo bien, es una gran idea conocer al profesor.  2 Visite los recursos de ayuda en línea. Preste atención a todos los recursos en línea o enlaces proporcionados por el departamento de química de su propia escuela.
2 Visite los recursos de ayuda en línea. Preste atención a todos los recursos en línea o enlaces proporcionados por el departamento de química de su propia escuela.  3 Intenta no abrumarte. La información detallada sobre los diferentes tipos de reacciones químicas, el intercambio de electrones, el cambio de la carga de un elemento o compuesto, y saber qué hacen los diferentes tipos de reacciones, puede ser muy confuso.
3 Intenta no abrumarte. La información detallada sobre los diferentes tipos de reacciones químicas, el intercambio de electrones, el cambio de la carga de un elemento o compuesto, y saber qué hacen los diferentes tipos de reacciones, puede ser muy confuso.