En química, la cromatografía en capa fina (TLC) es una forma económica, rápida y eficiente de separar una mezcla en sus componentes con fines analíticos. La cromatografía utiliza una fase estacionaria (generalmente sílice, alúmina) y una fase de disolvente móvil para separar compuestos. En el caso de TLC, las placas de vidrio están recubiertas con sílice y luego se permite que el solvente fluya sobre él, produciendo la separación de los compuestos. Cuando se aplica al trabajo de laboratorio, este método puede ayudar a determinar la pureza de las muestras, así como a controlar el progreso de una reacción. TLC es una técnica común que se enseña en los laboratorios de química de pregrado, sin embargo, mucha gente lucha con ella. El TLC casi siempre se utiliza en los laboratorios modernos de investigación química, por lo que es importante que las personas comprendan cómo hacerlo correctamente.
Pasos
-
 1 Cortar una gran placa de TLC de la caja en rectángulos. Es probable que necesite un cortador de vidrio a menos que las placas ya estén precalibradas. Hay dos lados en la placa TLC. Un lado de sílice y un lado de vidrio. El lado de vidrio es solo vidrio reflectante liso, y el lado de sílice es una sustancia blanca en polvo que se desprenderá si lo molestas. Por lo tanto, tenga cuidado al manipular estas placas para no dañar el gel de sílice. ¡Tocar el sílice con los dedos debe evitarse!
1 Cortar una gran placa de TLC de la caja en rectángulos. Es probable que necesite un cortador de vidrio a menos que las placas ya estén precalibradas. Hay dos lados en la placa TLC. Un lado de sílice y un lado de vidrio. El lado de vidrio es solo vidrio reflectante liso, y el lado de sílice es una sustancia blanca en polvo que se desprenderá si lo molestas. Por lo tanto, tenga cuidado al manipular estas placas para no dañar el gel de sílice. ¡Tocar el sílice con los dedos debe evitarse! - Mida las dimensiones de sus placas de 1.5 x 4 cm, o más grandes si cree que necesita más espacio, pero este tamaño suele ser suficiente. Luego, golpee ligeramente el lado del vidrio, no el lado de la sílice, con la cuchilla o el cortador de vidrio. Debería verse como la imagen de arriba, con cortes evidentes en el cristal. Ahora cuidadosamente levante el plato y bátalo doblándolo con sus manos lejos de usted. El vidrio se romperá fácilmente a lo largo de un borde liso si se puntúa. Tenga mucho cuidado, pero debe usar la fuerza suficiente para romper el cristal. Esto puede requerir algo de práctica si nunca lo has hecho antes.
-
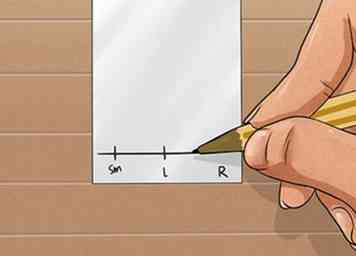 2 Marque la placa de TLC. Dibuje una línea al lapiz a unos 0.5 cm de la parte inferior en línea recta. Si está haciendo una reacción simple, como en la mayoría de los laboratorios de pregrado, dibuje tres trazos verticales espaciados uniformemente en la línea horizontal. Etiquete estas líneas como material de inicio (SM), punto de coincidencia (C) y reacción (R). Esto se explicará más en los pasos posteriores.
2 Marque la placa de TLC. Dibuje una línea al lapiz a unos 0.5 cm de la parte inferior en línea recta. Si está haciendo una reacción simple, como en la mayoría de los laboratorios de pregrado, dibuje tres trazos verticales espaciados uniformemente en la línea horizontal. Etiquete estas líneas como material de inicio (SM), punto de coincidencia (C) y reacción (R). Esto se explicará más en los pasos posteriores. - Solo usa el lápiz para escribir en el TLC. Si usa un bolígrafo o marcador, arruinará su placa de TLC porque estos medios contienen tintes que son compuestos orgánicos que se desarrollarán junto con sus compuestos de interés. El grafito no se moverá con el solvente. Escriba muy suavemente, de lo contrario raspará la sílice.
-
 3 Prepare su solvente de cromatografía. Un sistema solvente clásico es el acetato de etilo y el hexano porque se mezclan fácilmente y la polaridad del solvente se ajusta fácilmente. Un buen lugar para comenzar es con acetato de etilo al 20% en hexano, que es lo mismo que una solución 1: 4 de acetato de etilo a hexano. Puede medir fácilmente 1 ml de acetato de etilo y 4 ml de hexano en un cilindro graduado u otra herramienta de medición de líquidos, y luego combinarlos para obtener la solución deseada. En un recipiente cerrado, coloque un poco de acetato de etilo: hexano 1: 4, de modo que el fondo del recipiente apenas esté cubierto. Cierre la tapa del recipiente, de lo contrario el solvente se evaporará rápidamente y tendrá que agregar más.
3 Prepare su solvente de cromatografía. Un sistema solvente clásico es el acetato de etilo y el hexano porque se mezclan fácilmente y la polaridad del solvente se ajusta fácilmente. Un buen lugar para comenzar es con acetato de etilo al 20% en hexano, que es lo mismo que una solución 1: 4 de acetato de etilo a hexano. Puede medir fácilmente 1 ml de acetato de etilo y 4 ml de hexano en un cilindro graduado u otra herramienta de medición de líquidos, y luego combinarlos para obtener la solución deseada. En un recipiente cerrado, coloque un poco de acetato de etilo: hexano 1: 4, de modo que el fondo del recipiente apenas esté cubierto. Cierre la tapa del recipiente, de lo contrario el solvente se evaporará rápidamente y tendrá que agregar más. - En general, se debe emplear una mezcla de disolventes o disolventes de baja polaridad consistente con una buena separación.
-
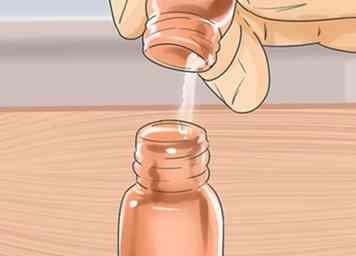 4 Prepare sus soluciones Tome el material de partida para su reacción y dilúyalo en un pequeño vial con acetato de etilo. La TLC es muy sensible e incluso una solución al 1% de tu compuesto es suficiente. Realmente solo necesitas una solución muy diluida para este procedimiento. De hecho, si su solución está demasiado concentrada, sus manchas se rayan y no obtendrá información útil de su placa de TLC. Si su reacción es también una buena solución, puede detectarla directamente, pero si la mezcla de reacción es más compleja, es posible que deba extraer una pequeña cantidad y diluirla en un solvente adecuado (como acetato de etilo) para hacer una solución. las mejores soluciones para detectar son claras, pero no tienen que serlo. El color de la solución no importa. En la imagen anterior, la solución es clara e incolora porque este compuesto no tiene color, pero a menudo las soluciones tienen color.
4 Prepare sus soluciones Tome el material de partida para su reacción y dilúyalo en un pequeño vial con acetato de etilo. La TLC es muy sensible e incluso una solución al 1% de tu compuesto es suficiente. Realmente solo necesitas una solución muy diluida para este procedimiento. De hecho, si su solución está demasiado concentrada, sus manchas se rayan y no obtendrá información útil de su placa de TLC. Si su reacción es también una buena solución, puede detectarla directamente, pero si la mezcla de reacción es más compleja, es posible que deba extraer una pequeña cantidad y diluirla en un solvente adecuado (como acetato de etilo) para hacer una solución. las mejores soluciones para detectar son claras, pero no tienen que serlo. El color de la solución no importa. En la imagen anterior, la solución es clara e incolora porque este compuesto no tiene color, pero a menudo las soluciones tienen color. -
 5 Tome una pequeña cantidad de solución. Sumerja la punta de una pipeta de vidrio en una de las soluciones de reacción que acaba de hacer, y la pipeta absorberá una pequeña cantidad. Esto se llama acción capilar y muchas personas se sorprenden de que esto funcione. Vea la imagen de arriba como prueba de que esto realmente funciona. Simplemente inserte el extremo de la pipeta en el líquido y parte de ella ingresará en la pipeta. No necesita mucha solución para detectar manchas en el plato, por lo que la punta de una pipeta es suficiente.
5 Tome una pequeña cantidad de solución. Sumerja la punta de una pipeta de vidrio en una de las soluciones de reacción que acaba de hacer, y la pipeta absorberá una pequeña cantidad. Esto se llama acción capilar y muchas personas se sorprenden de que esto funcione. Vea la imagen de arriba como prueba de que esto realmente funciona. Simplemente inserte el extremo de la pipeta en el líquido y parte de ella ingresará en la pipeta. No necesita mucha solución para detectar manchas en el plato, por lo que la punta de una pipeta es suficiente. -
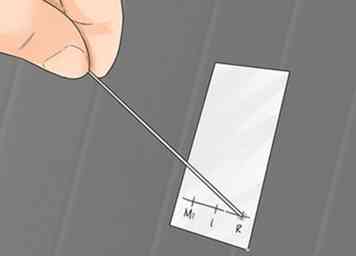 6 Presione ligeramente la punta de la pipeta en la intersección de una de las líneas punteadas y la línea horizontal que hizo previamente en el lado de la sílice. Esto causará que la solución en la pipeta se succione en la sílice, dando como resultado un pequeño círculo de solvente y compuesto. Es muy importante detectar a la ligera. Si presiona demasiado, depositará demasiado material, creando grandes puntos que se superpondrán, lo que hará que el TLC sea difícil de leer. Este paso requerirá práctica, por lo que es posible que desee probar esto varias veces, tratando de obtener la menor cantidad posible de puntos antes de continuar con el próximo paso.
6 Presione ligeramente la punta de la pipeta en la intersección de una de las líneas punteadas y la línea horizontal que hizo previamente en el lado de la sílice. Esto causará que la solución en la pipeta se succione en la sílice, dando como resultado un pequeño círculo de solvente y compuesto. Es muy importante detectar a la ligera. Si presiona demasiado, depositará demasiado material, creando grandes puntos que se superpondrán, lo que hará que el TLC sea difícil de leer. Este paso requerirá práctica, por lo que es posible que desee probar esto varias veces, tratando de obtener la menor cantidad posible de puntos antes de continuar con el próximo paso. - Ubique el material de partida en los guiones primero y segundo, y la solución de reacción en el segundo y tercer guiones. El primer trazo es la referencia del material de inicio (SM), el punto del medio es un punto de coincidencia (C) y el tercer punto es la referencia de la reacción (R). Este tipo de manchado hace que la placa desarrollada sea muy fácil de leer. La imagen de arriba para aclaración visual.
-
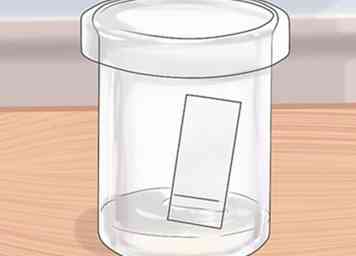 7 Seque la placa de TLC. Simplemente ajuste la placa y espere un minuto aproximadamente para que el solvente se evapore de la placa. No puede ejecutar la placa si todavía hay solvente.Podrá ver una mancha húmeda en el plato si hay solvente. No necesita esperar demasiado para solventes volátiles como acetato de etilo y hexano. Un minuto es tiempo más que suficiente para que estos solventes se evaporen.
7 Seque la placa de TLC. Simplemente ajuste la placa y espere un minuto aproximadamente para que el solvente se evapore de la placa. No puede ejecutar la placa si todavía hay solvente.Podrá ver una mancha húmeda en el plato si hay solvente. No necesita esperar demasiado para solventes volátiles como acetato de etilo y hexano. Un minuto es tiempo más que suficiente para que estos solventes se evaporen. - 8 Desarrolla el plato. Con unas pinzas, coloque suavemente la placa de TLC en el recipiente de disolvente, con el extremo manchado de la placa en la parte inferior cerca del disolvente. Sumerja el borde inferior de la placa en el solvente, permitiendo que el solvente corra por la placa, llevando los compuestos junto con ella. Cubra el recipiente con la tapa. Esto evitará que el solvente se evapore y hará que la etapa de desarrollo sea mucho más rápida.
- 9Deje que el jar / sistema no se altere, de lo contrario la banda se distorsionará.
-
 10 Esta es la etapa donde ocurre la separación. Así que sea paciente y espere 2-3 minutos para que el solvente llegue a la parte superior del plato antes de quitarlo. Esperar más tiempo generalmente proporciona mejores resultados, siempre y cuando no permita que el solvente fluya más allá del borde superior.
10 Esta es la etapa donde ocurre la separación. Así que sea paciente y espere 2-3 minutos para que el solvente llegue a la parte superior del plato antes de quitarlo. Esperar más tiempo generalmente proporciona mejores resultados, siempre y cuando no permita que el solvente fluya más allá del borde superior. -
 11 Retire la placa. Una vez que el solvente se acerca al borde superior de la placa, use unas pinzas para retirarlo con cuidado de la cámara. Marque rápidamente con lápiz el lugar más alto al que llegó el solvente. Esto se conoce como el frente solvente y es importante tenerlo en cuenta para cálculos posteriores. No toque la sílice con los dedos ya que podría manchar las manchas o depositar compuestos de sus manos en el plato, haciendo que su placa sea inútil.
11 Retire la placa. Una vez que el solvente se acerca al borde superior de la placa, use unas pinzas para retirarlo con cuidado de la cámara. Marque rápidamente con lápiz el lugar más alto al que llegó el solvente. Esto se conoce como el frente solvente y es importante tenerlo en cuenta para cálculos posteriores. No toque la sílice con los dedos ya que podría manchar las manchas o depositar compuestos de sus manos en el plato, haciendo que su placa sea inútil. -
 12 Seca el plato. Nuevamente, espere a que el solvente se evapore de la placa. Esto solo tomará un minuto o menos si está usando un solvente volátil como acetato de etilo, hexano, pero es importante no tener solvente en su plato.
12 Seca el plato. Nuevamente, espere a que el solvente se evapore de la placa. Esto solo tomará un minuto o menos si está usando un solvente volátil como acetato de etilo, hexano, pero es importante no tener solvente en su plato. - 13Visualiza el plato.
-
 14 Coloque la placa bajo una luz ultravioleta. Debería notar varios puntos en diferentes lugares, que corresponden a diferentes compuestos. La presencia o ausencia de manchas corresponde al progreso de una reacción, por lo que la información sobre una reacción se puede determinar fácilmente de esta manera. Use un lápiz para delinear las manchas para que pueda continuar analizando la placa después de retirarla de la fuente de luz ultravioleta. Mire la imagen de arriba y observe los diferentes puntos a diferentes alturas.
14 Coloque la placa bajo una luz ultravioleta. Debería notar varios puntos en diferentes lugares, que corresponden a diferentes compuestos. La presencia o ausencia de manchas corresponde al progreso de una reacción, por lo que la información sobre una reacción se puede determinar fácilmente de esta manera. Use un lápiz para delinear las manchas para que pueda continuar analizando la placa después de retirarla de la fuente de luz ultravioleta. Mire la imagen de arriba y observe los diferentes puntos a diferentes alturas. -
 15 Calcule el factor de retardo (Rf). Esta es simplemente la proporción de cuánto han cambiado las manchas hasta qué punto se ha movido el solvente. Use una regla para medir la distancia al frente del solvente y al centro de las manchas. Divida la distancia que los puntos se movieron por la distancia que el solvente se movió. Esto le dará un número entre 0 y 1. Al calcular el Rf de compuestos conocidos, puede identificarlos en una placa de TLC. Los diferentes compuestos casi siempre tendrán diferentes valores de Rf, lo que los hace fáciles de distinguir.
15 Calcule el factor de retardo (Rf). Esta es simplemente la proporción de cuánto han cambiado las manchas hasta qué punto se ha movido el solvente. Use una regla para medir la distancia al frente del solvente y al centro de las manchas. Divida la distancia que los puntos se movieron por la distancia que el solvente se movió. Esto le dará un número entre 0 y 1. Al calcular el Rf de compuestos conocidos, puede identificarlos en una placa de TLC. Los diferentes compuestos casi siempre tendrán diferentes valores de Rf, lo que los hace fáciles de distinguir.
 Minotauromaquia
Minotauromaquia
 1 Cortar una gran placa de TLC de la caja en rectángulos. Es probable que necesite un cortador de vidrio a menos que las placas ya estén precalibradas. Hay dos lados en la placa TLC. Un lado de sílice y un lado de vidrio. El lado de vidrio es solo vidrio reflectante liso, y el lado de sílice es una sustancia blanca en polvo que se desprenderá si lo molestas. Por lo tanto, tenga cuidado al manipular estas placas para no dañar el gel de sílice. ¡Tocar el sílice con los dedos debe evitarse!
1 Cortar una gran placa de TLC de la caja en rectángulos. Es probable que necesite un cortador de vidrio a menos que las placas ya estén precalibradas. Hay dos lados en la placa TLC. Un lado de sílice y un lado de vidrio. El lado de vidrio es solo vidrio reflectante liso, y el lado de sílice es una sustancia blanca en polvo que se desprenderá si lo molestas. Por lo tanto, tenga cuidado al manipular estas placas para no dañar el gel de sílice. ¡Tocar el sílice con los dedos debe evitarse!  2 Marque la placa de TLC. Dibuje una línea al lapiz a unos 0.5 cm de la parte inferior en línea recta. Si está haciendo una reacción simple, como en la mayoría de los laboratorios de pregrado, dibuje tres trazos verticales espaciados uniformemente en la línea horizontal. Etiquete estas líneas como material de inicio (SM), punto de coincidencia (C) y reacción (R). Esto se explicará más en los pasos posteriores.
2 Marque la placa de TLC. Dibuje una línea al lapiz a unos 0.5 cm de la parte inferior en línea recta. Si está haciendo una reacción simple, como en la mayoría de los laboratorios de pregrado, dibuje tres trazos verticales espaciados uniformemente en la línea horizontal. Etiquete estas líneas como material de inicio (SM), punto de coincidencia (C) y reacción (R). Esto se explicará más en los pasos posteriores.  3 Prepare su solvente de cromatografía. Un sistema solvente clásico es el acetato de etilo y el hexano porque se mezclan fácilmente y la polaridad del solvente se ajusta fácilmente. Un buen lugar para comenzar es con acetato de etilo al 20% en hexano, que es lo mismo que una solución 1: 4 de acetato de etilo a hexano. Puede medir fácilmente 1 ml de acetato de etilo y 4 ml de hexano en un cilindro graduado u otra herramienta de medición de líquidos, y luego combinarlos para obtener la solución deseada. En un recipiente cerrado, coloque un poco de acetato de etilo: hexano 1: 4, de modo que el fondo del recipiente apenas esté cubierto. Cierre la tapa del recipiente, de lo contrario el solvente se evaporará rápidamente y tendrá que agregar más.
3 Prepare su solvente de cromatografía. Un sistema solvente clásico es el acetato de etilo y el hexano porque se mezclan fácilmente y la polaridad del solvente se ajusta fácilmente. Un buen lugar para comenzar es con acetato de etilo al 20% en hexano, que es lo mismo que una solución 1: 4 de acetato de etilo a hexano. Puede medir fácilmente 1 ml de acetato de etilo y 4 ml de hexano en un cilindro graduado u otra herramienta de medición de líquidos, y luego combinarlos para obtener la solución deseada. En un recipiente cerrado, coloque un poco de acetato de etilo: hexano 1: 4, de modo que el fondo del recipiente apenas esté cubierto. Cierre la tapa del recipiente, de lo contrario el solvente se evaporará rápidamente y tendrá que agregar más.  4 Prepare sus soluciones Tome el material de partida para su reacción y dilúyalo en un pequeño vial con acetato de etilo. La TLC es muy sensible e incluso una solución al 1% de tu compuesto es suficiente. Realmente solo necesitas una solución muy diluida para este procedimiento. De hecho, si su solución está demasiado concentrada, sus manchas se rayan y no obtendrá información útil de su placa de TLC. Si su reacción es también una buena solución, puede detectarla directamente, pero si la mezcla de reacción es más compleja, es posible que deba extraer una pequeña cantidad y diluirla en un solvente adecuado (como acetato de etilo) para hacer una solución. las mejores soluciones para detectar son claras, pero no tienen que serlo. El color de la solución no importa. En la imagen anterior, la solución es clara e incolora porque este compuesto no tiene color, pero a menudo las soluciones tienen color.
4 Prepare sus soluciones Tome el material de partida para su reacción y dilúyalo en un pequeño vial con acetato de etilo. La TLC es muy sensible e incluso una solución al 1% de tu compuesto es suficiente. Realmente solo necesitas una solución muy diluida para este procedimiento. De hecho, si su solución está demasiado concentrada, sus manchas se rayan y no obtendrá información útil de su placa de TLC. Si su reacción es también una buena solución, puede detectarla directamente, pero si la mezcla de reacción es más compleja, es posible que deba extraer una pequeña cantidad y diluirla en un solvente adecuado (como acetato de etilo) para hacer una solución. las mejores soluciones para detectar son claras, pero no tienen que serlo. El color de la solución no importa. En la imagen anterior, la solución es clara e incolora porque este compuesto no tiene color, pero a menudo las soluciones tienen color.  5 Tome una pequeña cantidad de solución. Sumerja la punta de una pipeta de vidrio en una de las soluciones de reacción que acaba de hacer, y la pipeta absorberá una pequeña cantidad. Esto se llama acción capilar y muchas personas se sorprenden de que esto funcione. Vea la imagen de arriba como prueba de que esto realmente funciona. Simplemente inserte el extremo de la pipeta en el líquido y parte de ella ingresará en la pipeta. No necesita mucha solución para detectar manchas en el plato, por lo que la punta de una pipeta es suficiente.
5 Tome una pequeña cantidad de solución. Sumerja la punta de una pipeta de vidrio en una de las soluciones de reacción que acaba de hacer, y la pipeta absorberá una pequeña cantidad. Esto se llama acción capilar y muchas personas se sorprenden de que esto funcione. Vea la imagen de arriba como prueba de que esto realmente funciona. Simplemente inserte el extremo de la pipeta en el líquido y parte de ella ingresará en la pipeta. No necesita mucha solución para detectar manchas en el plato, por lo que la punta de una pipeta es suficiente.  6 Presione ligeramente la punta de la pipeta en la intersección de una de las líneas punteadas y la línea horizontal que hizo previamente en el lado de la sílice. Esto causará que la solución en la pipeta se succione en la sílice, dando como resultado un pequeño círculo de solvente y compuesto. Es muy importante detectar a la ligera. Si presiona demasiado, depositará demasiado material, creando grandes puntos que se superpondrán, lo que hará que el TLC sea difícil de leer. Este paso requerirá práctica, por lo que es posible que desee probar esto varias veces, tratando de obtener la menor cantidad posible de puntos antes de continuar con el próximo paso.
6 Presione ligeramente la punta de la pipeta en la intersección de una de las líneas punteadas y la línea horizontal que hizo previamente en el lado de la sílice. Esto causará que la solución en la pipeta se succione en la sílice, dando como resultado un pequeño círculo de solvente y compuesto. Es muy importante detectar a la ligera. Si presiona demasiado, depositará demasiado material, creando grandes puntos que se superpondrán, lo que hará que el TLC sea difícil de leer. Este paso requerirá práctica, por lo que es posible que desee probar esto varias veces, tratando de obtener la menor cantidad posible de puntos antes de continuar con el próximo paso.  7 Seque la placa de TLC. Simplemente ajuste la placa y espere un minuto aproximadamente para que el solvente se evapore de la placa. No puede ejecutar la placa si todavía hay solvente.Podrá ver una mancha húmeda en el plato si hay solvente. No necesita esperar demasiado para solventes volátiles como acetato de etilo y hexano. Un minuto es tiempo más que suficiente para que estos solventes se evaporen.
7 Seque la placa de TLC. Simplemente ajuste la placa y espere un minuto aproximadamente para que el solvente se evapore de la placa. No puede ejecutar la placa si todavía hay solvente.Podrá ver una mancha húmeda en el plato si hay solvente. No necesita esperar demasiado para solventes volátiles como acetato de etilo y hexano. Un minuto es tiempo más que suficiente para que estos solventes se evaporen.  10 Esta es la etapa donde ocurre la separación. Así que sea paciente y espere 2-3 minutos para que el solvente llegue a la parte superior del plato antes de quitarlo. Esperar más tiempo generalmente proporciona mejores resultados, siempre y cuando no permita que el solvente fluya más allá del borde superior.
10 Esta es la etapa donde ocurre la separación. Así que sea paciente y espere 2-3 minutos para que el solvente llegue a la parte superior del plato antes de quitarlo. Esperar más tiempo generalmente proporciona mejores resultados, siempre y cuando no permita que el solvente fluya más allá del borde superior.  11 Retire la placa. Una vez que el solvente se acerca al borde superior de la placa, use unas pinzas para retirarlo con cuidado de la cámara. Marque rápidamente con lápiz el lugar más alto al que llegó el solvente. Esto se conoce como el frente solvente y es importante tenerlo en cuenta para cálculos posteriores. No toque la sílice con los dedos ya que podría manchar las manchas o depositar compuestos de sus manos en el plato, haciendo que su placa sea inútil.
11 Retire la placa. Una vez que el solvente se acerca al borde superior de la placa, use unas pinzas para retirarlo con cuidado de la cámara. Marque rápidamente con lápiz el lugar más alto al que llegó el solvente. Esto se conoce como el frente solvente y es importante tenerlo en cuenta para cálculos posteriores. No toque la sílice con los dedos ya que podría manchar las manchas o depositar compuestos de sus manos en el plato, haciendo que su placa sea inútil.  12 Seca el plato. Nuevamente, espere a que el solvente se evapore de la placa. Esto solo tomará un minuto o menos si está usando un solvente volátil como acetato de etilo, hexano, pero es importante no tener solvente en su plato.
12 Seca el plato. Nuevamente, espere a que el solvente se evapore de la placa. Esto solo tomará un minuto o menos si está usando un solvente volátil como acetato de etilo, hexano, pero es importante no tener solvente en su plato.  14 Coloque la placa bajo una luz ultravioleta. Debería notar varios puntos en diferentes lugares, que corresponden a diferentes compuestos. La presencia o ausencia de manchas corresponde al progreso de una reacción, por lo que la información sobre una reacción se puede determinar fácilmente de esta manera. Use un lápiz para delinear las manchas para que pueda continuar analizando la placa después de retirarla de la fuente de luz ultravioleta. Mire la imagen de arriba y observe los diferentes puntos a diferentes alturas.
14 Coloque la placa bajo una luz ultravioleta. Debería notar varios puntos en diferentes lugares, que corresponden a diferentes compuestos. La presencia o ausencia de manchas corresponde al progreso de una reacción, por lo que la información sobre una reacción se puede determinar fácilmente de esta manera. Use un lápiz para delinear las manchas para que pueda continuar analizando la placa después de retirarla de la fuente de luz ultravioleta. Mire la imagen de arriba y observe los diferentes puntos a diferentes alturas.  15 Calcule el factor de retardo (Rf). Esta es simplemente la proporción de cuánto han cambiado las manchas hasta qué punto se ha movido el solvente. Use una regla para medir la distancia al frente del solvente y al centro de las manchas. Divida la distancia que los puntos se movieron por la distancia que el solvente se movió. Esto le dará un número entre 0 y 1. Al calcular el Rf de compuestos conocidos, puede identificarlos en una placa de TLC. Los diferentes compuestos casi siempre tendrán diferentes valores de Rf, lo que los hace fáciles de distinguir.
15 Calcule el factor de retardo (Rf). Esta es simplemente la proporción de cuánto han cambiado las manchas hasta qué punto se ha movido el solvente. Use una regla para medir la distancia al frente del solvente y al centro de las manchas. Divida la distancia que los puntos se movieron por la distancia que el solvente se movió. Esto le dará un número entre 0 y 1. Al calcular el Rf de compuestos conocidos, puede identificarlos en una placa de TLC. Los diferentes compuestos casi siempre tendrán diferentes valores de Rf, lo que los hace fáciles de distinguir.