Si considera que la tabla periódica es confusa y difícil de entender, ¡no está solo! Comprender cómo funciona puede ser difícil, pero aprender a leerlo te ayudará a tener éxito en las ciencias. Comience por reconocer la estructura de la tabla periódica y lo que esto le dice sobre cada elemento. A continuación, puedes estudiar cada elemento. Finalmente, use la información proporcionada en la tabla periódica para encontrar la cantidad de neutrones en un átomo.
Parte uno de tres:
Reconociendo la Estructura de la Tabla Periódica
-
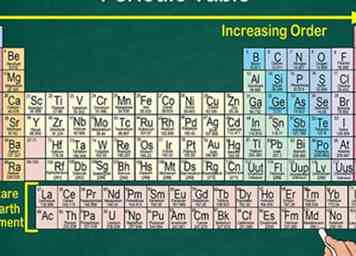 1 Lea la tabla periódica desde arriba a la izquierda a abajo a la derecha. Los elementos están ordenados por sus números atómicos, que aumentan a medida que avanzas y bajas por la tabla periódica. El número atómico es cuántos protones posee el átomo del elemento. También notarás que la masa atómica de cada elemento aumenta a medida que te mueves por la mesa. Esto significa que puede reconocer mucho sobre el peso de un elemento simplemente mirando su lugar en la mesa.
1 Lea la tabla periódica desde arriba a la izquierda a abajo a la derecha. Los elementos están ordenados por sus números atómicos, que aumentan a medida que avanzas y bajas por la tabla periódica. El número atómico es cuántos protones posee el átomo del elemento. También notarás que la masa atómica de cada elemento aumenta a medida que te mueves por la mesa. Esto significa que puede reconocer mucho sobre el peso de un elemento simplemente mirando su lugar en la mesa. - La masa atómica aumenta a medida que avanzas o bajas por la tabla porque la masa se calcula sumando los protones y neutrones en el átomo de cada elemento. La cantidad de protones aumenta con cada elemento, lo que significa que el peso también aumenta.
- Los electrones no están incluidos en la masa atómica, ya que contribuyen mucho menos al peso del átomo que los protones y neutrones.[1]
-
 2 Observe que cada elemento contiene 1 protón más que su predecesor. Puedes ver esto mirando el número atómico. Los números atómicos se ordenan de izquierda a derecha. Como los elementos también están organizados por grupo, verá espacios en la tabla.[2]
2 Observe que cada elemento contiene 1 protón más que su predecesor. Puedes ver esto mirando el número atómico. Los números atómicos se ordenan de izquierda a derecha. Como los elementos también están organizados por grupo, verá espacios en la tabla.[2] - Por ejemplo, la primera fila contiene Hidrógeno, que tiene un número atómico de 1, y Helio, que tiene un número atómico de 2. Sin embargo, están en los extremos opuestos de la tabla, ya que están en diferentes grupos.
-
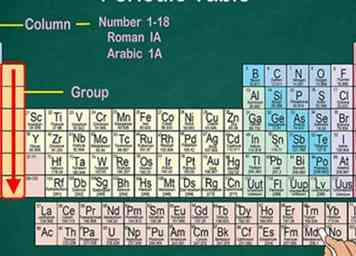 3 Reconocer grupos que comparten propiedades físicas y químicas. Los grupos, también conocidos como familias, caen en una columna vertical. En la mayoría de los casos, los grupos compartirán el mismo color también. Esto le ayuda a identificar qué elementos tienen propiedades físicas y químicas similares entre sí, lo que le permite predecir cómo se comportarán.[3] Cada elemento en un grupo particular tiene la misma cantidad de electrones en su orbital externo.[4]
3 Reconocer grupos que comparten propiedades físicas y químicas. Los grupos, también conocidos como familias, caen en una columna vertical. En la mayoría de los casos, los grupos compartirán el mismo color también. Esto le ayuda a identificar qué elementos tienen propiedades físicas y químicas similares entre sí, lo que le permite predecir cómo se comportarán.[3] Cada elemento en un grupo particular tiene la misma cantidad de electrones en su orbital externo.[4] - La mayoría de los elementos caen en 1 grupo, pero el Hidrógeno se puede colocar con la familia Halógeno o los metales alcalinos. En algunos cuadros, aparecerá con ambos.
- En la mayoría de los casos, las columnas estarán numeradas del 1 al 18, ya sea arriba o debajo de la tabla. Los números se pueden mostrar en números romanos (IA), números arábigos (1A) o números (1).
- Cuando bajas de un grupo de arriba a abajo, se llama "leer un grupo".
-
 4 Observe por qué existen vacíos en la tabla. Aunque los elementos se ordenan en función de su número atómico, también están organizados en grupos y familias que comparten las mismas propiedades físicas y químicas. Esto te ayuda a comprender mejor cómo se comporta cada elemento. Como los elementos no siempre se clasifican correctamente en agrupaciones a medida que aumentan en número, la tabla periódica contiene espacios.[5]
4 Observe por qué existen vacíos en la tabla. Aunque los elementos se ordenan en función de su número atómico, también están organizados en grupos y familias que comparten las mismas propiedades físicas y químicas. Esto te ayuda a comprender mejor cómo se comporta cada elemento. Como los elementos no siempre se clasifican correctamente en agrupaciones a medida que aumentan en número, la tabla periódica contiene espacios.[5] - Por ejemplo, las primeras 3 filas tienen espacios, ya que los metales de transición no aparecen en la tabla hasta el número atómico 21.
- De manera similar, los elementos 57 a 102, que son los Elementos de la Tierra Rara, usualmente se representan como un subconjunto en la parte inferior derecha de la tabla.
-
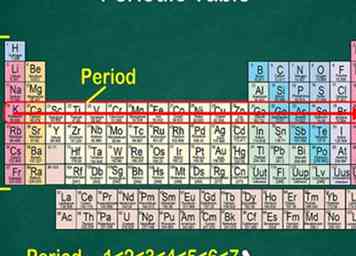 5 Observe que cada fila se llama un período. Todos los elementos en un período tienen el mismo número de orbitales atómicos, que es donde van sus electrones. El número de orbitales coincidirá con el número del período. Hay 7 filas, lo que significa que hay 7 períodos.[6]
5 Observe que cada fila se llama un período. Todos los elementos en un período tienen el mismo número de orbitales atómicos, que es donde van sus electrones. El número de orbitales coincidirá con el número del período. Hay 7 filas, lo que significa que hay 7 períodos.[6] - Por ejemplo, los elementos en el período 1 tienen 1 orbital, mientras que los elementos en el período 7 tienen 7 orbitales.
- En la mayoría de los casos, están numerados del 1 al 7 en el lado izquierdo de la mesa.
- Cuando se mueve a través de una fila de izquierda a derecha, se denomina "lectura durante un período".
-
 6 Distinga entre metales, semi-metales y no metales. Puede comprender mejor las propiedades de un elemento al reconocer qué tipo de elemento es. Afortunadamente, la mayoría de las tablas periódicas usan color para indicar si el elemento es de metal, de metal o no. Notarás que los metales se encuentran a la izquierda de la mesa, mientras que los no metales caen a la derecha. Los semi-metales están intercalados entre ellos.[7]
6 Distinga entre metales, semi-metales y no metales. Puede comprender mejor las propiedades de un elemento al reconocer qué tipo de elemento es. Afortunadamente, la mayoría de las tablas periódicas usan color para indicar si el elemento es de metal, de metal o no. Notarás que los metales se encuentran a la izquierda de la mesa, mientras que los no metales caen a la derecha. Los semi-metales están intercalados entre ellos.[7] - Tenga en cuenta que el hidrógeno se puede agrupar con los halógenos o los metales alcalinos debido a sus propiedades, por lo que puede aparecer a cada lado de la mesa o puede tener un color diferente.
- Los elementos se etiquetan como metal si tienen brillo, son sólidos a temperatura ambiente, conducen calor y electricidad, y son maleables y dúctiles.
- Los elementos se consideran no metálicos si carecen de brillo, no conducen calor o electricidad y no son maleables. Estos elementos son generalmente gases a temperatura ambiente, pero también pueden convertirse en sólidos o líquidos a ciertas temperaturas.
- Los elementos se etiquetan como semi-metales si tienen una mezcla de propiedades de metales y no metales.[8]
Parte dos de tres:
Estudiando los elementos
-
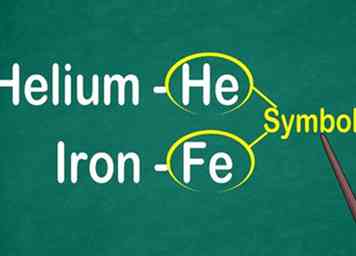 1 Reconoce el símbolo de 1 a 2 letras del elemento. Con mayor frecuencia aparece en el centro del cuadro en una fuente grande. El símbolo abrevia el nombre del elemento, que está estandarizado en diferentes idiomas. Cuando estás haciendo experimentos o trabajando con ecuaciones elementales, es probable que uses los símbolos de los elementos, por lo que es importante que te familiarices con ellos.[9]
1 Reconoce el símbolo de 1 a 2 letras del elemento. Con mayor frecuencia aparece en el centro del cuadro en una fuente grande. El símbolo abrevia el nombre del elemento, que está estandarizado en diferentes idiomas. Cuando estás haciendo experimentos o trabajando con ecuaciones elementales, es probable que uses los símbolos de los elementos, por lo que es importante que te familiarices con ellos.[9] - Este símbolo generalmente se deriva de la forma latina del nombre del elemento, pero puede derivarse del nombre común ampliamente aceptado, especialmente para los elementos más nuevos. Por ejemplo, el símbolo para Helium es He, que se parece mucho al nombre común. Sin embargo, el símbolo para Iron es Fe, que es más difícil de reconocer al principio.
-
 2 Busque el nombre completo del elemento, si está presente. Este es el nombre del elemento que usará al escribirlo. Por ejemplo, "Helio" y "Carbono" son los nombres de los elementos. En la mayoría de los casos, esto aparecerá justo debajo del símbolo, pero su ubicación puede variar.[10]
2 Busque el nombre completo del elemento, si está presente. Este es el nombre del elemento que usará al escribirlo. Por ejemplo, "Helio" y "Carbono" son los nombres de los elementos. En la mayoría de los casos, esto aparecerá justo debajo del símbolo, pero su ubicación puede variar.[10] - Algunas tablas periódicas pueden omitir el nombre completo, utilizando solo el símbolo.
-
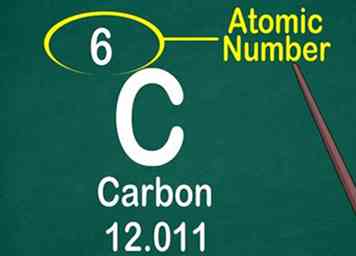 3 Encuentra el número atómico. El número atómico a menudo se encuentra en la parte superior de la caja, ya sea en el centro o en la esquina. Sin embargo, podría ubicarse debajo del símbolo o nombre del elemento. Los números atómicos se ejecutan secuencialmente desde 1-118.[11]
3 Encuentra el número atómico. El número atómico a menudo se encuentra en la parte superior de la caja, ya sea en el centro o en la esquina. Sin embargo, podría ubicarse debajo del símbolo o nombre del elemento. Los números atómicos se ejecutan secuencialmente desde 1-118.[11] - El número atómico será un número entero, no un decimal.
-
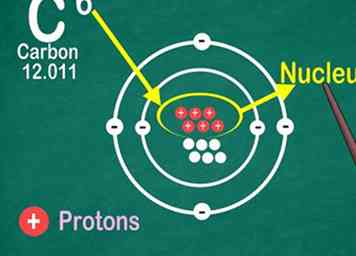 4 Reconoce que el número atómico es la cantidad de protones en un átomo. Todos los átomos de un elemento contienen la misma cantidad de protones. A diferencia de los electrones, un átomo no puede ganar o perder protones. De lo contrario, ¡el elemento cambiaría![12]
4 Reconoce que el número atómico es la cantidad de protones en un átomo. Todos los átomos de un elemento contienen la misma cantidad de protones. A diferencia de los electrones, un átomo no puede ganar o perder protones. De lo contrario, ¡el elemento cambiaría![12] - ¡Usarás el número atómico para encontrar la cantidad de electrones y neutrones también!
-
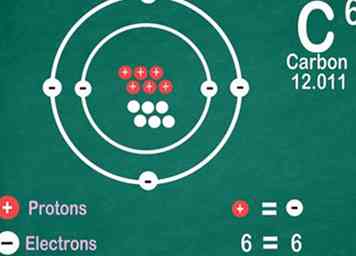 5 Sepa que los elementos contienen la misma cantidad de electrones que los protones. Hay una excepción si están ionizados. Los protones tienen una carga positiva y los electrones tienen una carga negativa. Como los átomos regulares no tienen carga eléctrica, eso significa que los electrones y protones son iguales. Sin embargo, un átomo puede perder o ganar electrones, lo que lo hace ionizado.[13]
5 Sepa que los elementos contienen la misma cantidad de electrones que los protones. Hay una excepción si están ionizados. Los protones tienen una carga positiva y los electrones tienen una carga negativa. Como los átomos regulares no tienen carga eléctrica, eso significa que los electrones y protones son iguales. Sin embargo, un átomo puede perder o ganar electrones, lo que lo hace ionizado.[13] - Los iones están cargados eléctricamente. Si un ion tiene más protones, es positivo, que se indica con un signo positivo al lado del símbolo del ion. Si tiene más electrones, el ion es negativo, lo que se indica con un símbolo negativo.
- No verá un símbolo de más o menos si el elemento no es un ion.
Parte tres de tres:
Usando el peso atómico para calcular los neutrones
-
 1 Encuentra el peso atómico. El peso atómico generalmente aparece en la parte inferior de la caja, debajo del símbolo del elemento. El peso atómico representa el peso combinado de las partículas en el núcleo, que incluye protones y neutrones. Sin embargo, los iones complican el cálculo, por lo que el peso atómico representa un promedio de la masa atómica del elemento y la masa atómica de sus iones.[14]
1 Encuentra el peso atómico. El peso atómico generalmente aparece en la parte inferior de la caja, debajo del símbolo del elemento. El peso atómico representa el peso combinado de las partículas en el núcleo, que incluye protones y neutrones. Sin embargo, los iones complican el cálculo, por lo que el peso atómico representa un promedio de la masa atómica del elemento y la masa atómica de sus iones.[14] - Debido a que los pesos se promedian, la mayoría de los elementos tendrán pesos atómicos que incluyen decimales.
- Aunque puede parecer que el peso atómico aumenta en número desde la parte superior izquierda hasta la parte inferior derecha, esto no es cierto en todos los casos.
- 2 Determine el número de masa del elemento que está estudiando. Puede encontrar el número de masa redondeando la masa atómica al número entero más cercano. Esto explica el hecho de que el peso atómico es un promedio de todas las masas atómicas posibles para ese elemento, incluidos los iones.[15]
- Por ejemplo, el peso atómico del carbono es 12.011, que se redondea a 12. De manera similar, el peso del hierro es 55.847, que se redondea a 56.
-
 3 Reste el número atómico del número de masa para encontrar los neutrones. El número de masa se calcula sumando el número de protones y neutrones. ¡Esto le permite encontrar fácilmente el número de neutrones en un átomo al restar el número o protones del número de masa![16]
3 Reste el número atómico del número de masa para encontrar los neutrones. El número de masa se calcula sumando el número de protones y neutrones. ¡Esto le permite encontrar fácilmente el número de neutrones en un átomo al restar el número o protones del número de masa![16] - Usa esta fórmula: Neutrones = Número masivo - Protones
- Por ejemplo, el número de masa de carbono es 12 y tiene 6 protones. Desde 12 - 6 = 6, sabes que Carbon tiene 6 neutrones.
- Para otro ejemplo, el número de masa de Iron es 56 y tiene 26 protones. Como 56 - 26 = 30, sabes que el hierro tiene 30 neutrones.
- Los isótopos de un átomo contendrán una cantidad diferente de neutrones, lo que cambia el peso del átomo.
Muestra de la tabla periódica
 Muestra de la tabla periódica
Muestra de la tabla periódica
 Minotauromaquia
Minotauromaquia
 1 Lea la tabla periódica desde arriba a la izquierda a abajo a la derecha. Los elementos están ordenados por sus números atómicos, que aumentan a medida que avanzas y bajas por la tabla periódica. El número atómico es cuántos protones posee el átomo del elemento. También notarás que la masa atómica de cada elemento aumenta a medida que te mueves por la mesa. Esto significa que puede reconocer mucho sobre el peso de un elemento simplemente mirando su lugar en la mesa.
1 Lea la tabla periódica desde arriba a la izquierda a abajo a la derecha. Los elementos están ordenados por sus números atómicos, que aumentan a medida que avanzas y bajas por la tabla periódica. El número atómico es cuántos protones posee el átomo del elemento. También notarás que la masa atómica de cada elemento aumenta a medida que te mueves por la mesa. Esto significa que puede reconocer mucho sobre el peso de un elemento simplemente mirando su lugar en la mesa.  3 Reconocer grupos que comparten propiedades físicas y químicas. Los grupos, también conocidos como familias, caen en una columna vertical. En la mayoría de los casos, los grupos compartirán el mismo color también. Esto le ayuda a identificar qué elementos tienen propiedades físicas y químicas similares entre sí, lo que le permite predecir cómo se comportarán.[3] Cada elemento en un grupo particular tiene la misma cantidad de electrones en su orbital externo.[4]
3 Reconocer grupos que comparten propiedades físicas y químicas. Los grupos, también conocidos como familias, caen en una columna vertical. En la mayoría de los casos, los grupos compartirán el mismo color también. Esto le ayuda a identificar qué elementos tienen propiedades físicas y químicas similares entre sí, lo que le permite predecir cómo se comportarán.[3] Cada elemento en un grupo particular tiene la misma cantidad de electrones en su orbital externo.[4]  5 Observe que cada fila se llama un período. Todos los elementos en un período tienen el mismo número de orbitales atómicos, que es donde van sus electrones. El número de orbitales coincidirá con el número del período. Hay 7 filas, lo que significa que hay 7 períodos.[6]
5 Observe que cada fila se llama un período. Todos los elementos en un período tienen el mismo número de orbitales atómicos, que es donde van sus electrones. El número de orbitales coincidirá con el número del período. Hay 7 filas, lo que significa que hay 7 períodos.[6]  6 Distinga entre metales, semi-metales y no metales. Puede comprender mejor las propiedades de un elemento al reconocer qué tipo de elemento es. Afortunadamente, la mayoría de las tablas periódicas usan color para indicar si el elemento es de metal, de metal o no. Notarás que los metales se encuentran a la izquierda de la mesa, mientras que los no metales caen a la derecha. Los semi-metales están intercalados entre ellos.[7]
6 Distinga entre metales, semi-metales y no metales. Puede comprender mejor las propiedades de un elemento al reconocer qué tipo de elemento es. Afortunadamente, la mayoría de las tablas periódicas usan color para indicar si el elemento es de metal, de metal o no. Notarás que los metales se encuentran a la izquierda de la mesa, mientras que los no metales caen a la derecha. Los semi-metales están intercalados entre ellos.[7] 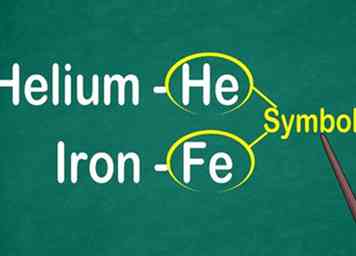 1 Reconoce el símbolo de 1 a 2 letras del elemento. Con mayor frecuencia aparece en el centro del cuadro en una fuente grande. El símbolo abrevia el nombre del elemento, que está estandarizado en diferentes idiomas. Cuando estás haciendo experimentos o trabajando con ecuaciones elementales, es probable que uses los símbolos de los elementos, por lo que es importante que te familiarices con ellos.[9]
1 Reconoce el símbolo de 1 a 2 letras del elemento. Con mayor frecuencia aparece en el centro del cuadro en una fuente grande. El símbolo abrevia el nombre del elemento, que está estandarizado en diferentes idiomas. Cuando estás haciendo experimentos o trabajando con ecuaciones elementales, es probable que uses los símbolos de los elementos, por lo que es importante que te familiarices con ellos.[9]  2 Busque el nombre completo del elemento, si está presente. Este es el nombre del elemento que usará al escribirlo. Por ejemplo, "Helio" y "Carbono" son los nombres de los elementos. En la mayoría de los casos, esto aparecerá justo debajo del símbolo, pero su ubicación puede variar.[10]
2 Busque el nombre completo del elemento, si está presente. Este es el nombre del elemento que usará al escribirlo. Por ejemplo, "Helio" y "Carbono" son los nombres de los elementos. En la mayoría de los casos, esto aparecerá justo debajo del símbolo, pero su ubicación puede variar.[10]  3 Encuentra el número atómico. El número atómico a menudo se encuentra en la parte superior de la caja, ya sea en el centro o en la esquina. Sin embargo, podría ubicarse debajo del símbolo o nombre del elemento. Los números atómicos se ejecutan secuencialmente desde 1-118.[11]
3 Encuentra el número atómico. El número atómico a menudo se encuentra en la parte superior de la caja, ya sea en el centro o en la esquina. Sin embargo, podría ubicarse debajo del símbolo o nombre del elemento. Los números atómicos se ejecutan secuencialmente desde 1-118.[11]  4 Reconoce que el número atómico es la cantidad de protones en un átomo. Todos los átomos de un elemento contienen la misma cantidad de protones. A diferencia de los electrones, un átomo no puede ganar o perder protones. De lo contrario, ¡el elemento cambiaría![12]
4 Reconoce que el número atómico es la cantidad de protones en un átomo. Todos los átomos de un elemento contienen la misma cantidad de protones. A diferencia de los electrones, un átomo no puede ganar o perder protones. De lo contrario, ¡el elemento cambiaría![12]  5 Sepa que los elementos contienen la misma cantidad de electrones que los protones. Hay una excepción si están ionizados. Los protones tienen una carga positiva y los electrones tienen una carga negativa. Como los átomos regulares no tienen carga eléctrica, eso significa que los electrones y protones son iguales. Sin embargo, un átomo puede perder o ganar electrones, lo que lo hace ionizado.[13]
5 Sepa que los elementos contienen la misma cantidad de electrones que los protones. Hay una excepción si están ionizados. Los protones tienen una carga positiva y los electrones tienen una carga negativa. Como los átomos regulares no tienen carga eléctrica, eso significa que los electrones y protones son iguales. Sin embargo, un átomo puede perder o ganar electrones, lo que lo hace ionizado.[13]  1 Encuentra el peso atómico. El peso atómico generalmente aparece en la parte inferior de la caja, debajo del símbolo del elemento. El peso atómico representa el peso combinado de las partículas en el núcleo, que incluye protones y neutrones. Sin embargo, los iones complican el cálculo, por lo que el peso atómico representa un promedio de la masa atómica del elemento y la masa atómica de sus iones.[14]
1 Encuentra el peso atómico. El peso atómico generalmente aparece en la parte inferior de la caja, debajo del símbolo del elemento. El peso atómico representa el peso combinado de las partículas en el núcleo, que incluye protones y neutrones. Sin embargo, los iones complican el cálculo, por lo que el peso atómico representa un promedio de la masa atómica del elemento y la masa atómica de sus iones.[14]  3 Reste el número atómico del número de masa para encontrar los neutrones. El número de masa se calcula sumando el número de protones y neutrones. ¡Esto le permite encontrar fácilmente el número de neutrones en un átomo al restar el número o protones del número de masa![16]
3 Reste el número atómico del número de masa para encontrar los neutrones. El número de masa se calcula sumando el número de protones y neutrones. ¡Esto le permite encontrar fácilmente el número de neutrones en un átomo al restar el número o protones del número de masa![16]