La química orgánica es el estudio del carbono y sus compuestos químicos. El tema puede ser vasto y difícil de entender al principio. Afortunadamente, con persistencia, es comprensible. Comprender la química orgánica es crucial para cualquier persona interesada en productos químicos naturales o creados por el hombre, incluidos los que se encuentran en alimentos, bebidas e incluso en nuestros propios cuerpos.
Parte uno de tres:
Reconociendo las reacciones químicas orgánicas comunes
-
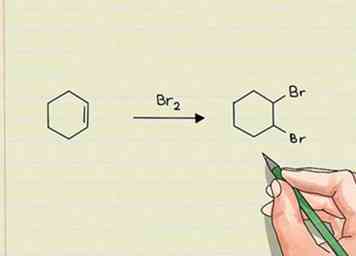 1 Busque un mayor número de enlaces sigma para identificar reacciones de adición. En otras palabras, busque un mayor número de átomos que en la molécula original. Esto normalmente se permite al romper un enlace pi o unirse a un conjunto de electrones desapareados en la molécula. Las reacciones de adición no "intercambian" un átomo o grupo por otro. Simplemente agregan algo nuevo.[1]
1 Busque un mayor número de enlaces sigma para identificar reacciones de adición. En otras palabras, busque un mayor número de átomos que en la molécula original. Esto normalmente se permite al romper un enlace pi o unirse a un conjunto de electrones desapareados en la molécula. Las reacciones de adición no "intercambian" un átomo o grupo por otro. Simplemente agregan algo nuevo.[1] - Las reacciones de adición generalmente ocurren cuando se atacan enlaces dobles o triples. Por ejemplo, si hay un doble enlace entre dos átomos de carbono, y si se agrega hidrógeno a través del enlace, se produciría la adición de hidrógeno a la molécula. Ninguna otra especie se iría.
-
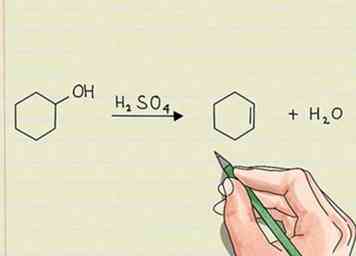 2 Busque un mayor número de enlaces pi para indicar reacciones de eliminación. Esto es lo opuesto a una reacción de adición. Algo será quitado de la molécula original y dejará atrás electrones. Estos electrones no ligados aparecerán como un par solitario o formarán un enlace pi en la molécula.[2]
2 Busque un mayor número de enlaces pi para indicar reacciones de eliminación. Esto es lo opuesto a una reacción de adición. Algo será quitado de la molécula original y dejará atrás electrones. Estos electrones no ligados aparecerán como un par solitario o formarán un enlace pi en la molécula.[2] - Si elimina el hidrógeno de una cadena de hidrocarburos, el resultado sería que los electrones desapareados entran en un doble enlace entre dos de los átomos de carbono. Esto no requiere que se agregue nada más, solo elimina el hidrógeno.
-
 3 Observe cualquier "intercambio" molecular para seleccionar reacciones de sustitución. Se produce una reacción de sustitución cuando se elimina un grupo (A) de la molécula y se reemplaza por un nuevo grupo (B). Esto no necesariamente cambia la cantidad de enlaces pi o sigma en la molécula, como vería con las reacciones de adición y eliminación. Los tipos comunes de reacciones de sustitución son:[3]
3 Observe cualquier "intercambio" molecular para seleccionar reacciones de sustitución. Se produce una reacción de sustitución cuando se elimina un grupo (A) de la molécula y se reemplaza por un nuevo grupo (B). Esto no necesariamente cambia la cantidad de enlaces pi o sigma en la molécula, como vería con las reacciones de adición y eliminación. Los tipos comunes de reacciones de sustitución son:[3] - Sustitución nucleofílica: cuando un nucleófilo reemplaza a otro nucleófilo en la reacción.
- Sustitución electrofílica: cuando un electrófilo reemplaza a otro electrófilo en la reacción.
- SN1 - Una reacción de sustitución que involucra solo una molécula en el estado de transición. En otras palabras, el grupo saliente se va primero, y luego el nuevo grupo es libre de atacar la molécula.[4]
- SN2 - En este tipo de reacción, el estado de transición se forma a partir de dos moléculas. Esto sucede porque el nuevo grupo ataca a la molécula en un sitio disponible, y el grupo saliente se ve obligado a abandonar.[5]
-
 4 Ubique las reacciones de reordenamiento cuando el producto tenga la misma fórmula que la molécula original. Los reordenamientos forman isómeros: moléculas que tienen exactamente los mismos átomos presentes pero en una configuración diferente. Los isómeros tendrán la misma fórmula química, pero diferentes propiedades que son exclusivas de su configuración. El número de enlaces generalmente no se ve afectado en los reordenamientos, también.[6]
4 Ubique las reacciones de reordenamiento cuando el producto tenga la misma fórmula que la molécula original. Los reordenamientos forman isómeros: moléculas que tienen exactamente los mismos átomos presentes pero en una configuración diferente. Los isómeros tendrán la misma fórmula química, pero diferentes propiedades que son exclusivas de su configuración. El número de enlaces generalmente no se ve afectado en los reordenamientos, también.[6] - Hay un subconjunto de reacciones de reorganización conocido como tautomerización. Esto es cuando dos isómeros se mueven rápidamente entre sí.
-
 5 Considere otras reacciones importantes que pueden afectar las moléculas orgánicas. Las reacciones de oxidación-reducción (o redox) son muy comunes en la química orgánica, al igual que las reacciones radicales. Deberías estar un poco familiarizado con estas reacciones de la química inorgánica general, pero es una buena idea revisarlas.[7]
5 Considere otras reacciones importantes que pueden afectar las moléculas orgánicas. Las reacciones de oxidación-reducción (o redox) son muy comunes en la química orgánica, al igual que las reacciones radicales. Deberías estar un poco familiarizado con estas reacciones de la química inorgánica general, pero es una buena idea revisarlas.[7] - Si continúa su búsqueda de la química orgánica, encontrará reacciones más complicadas que ocurren bajo condiciones especializadas, pero seguirán los mismos fundamentos básicos que todas las reacciones orgánicas.
Parte dos de tres:
Comprensión de las tendencias de la Química Orgánica Básica
-
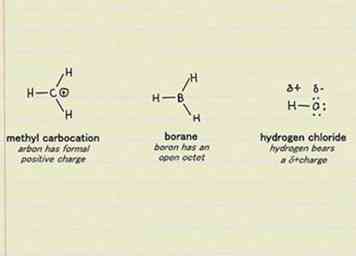 1 Identificar electrófilos en los mecanismos de reacción de la química orgánica. La palabra electrófilo se refiere a especies "amantes de los electrones". Esto se aplica a átomos, moléculas e iones. Si puede aceptar un par de electrones, se lo considera un electrófilo. Solo recuerda que no todos los electrófilos atraen electrones con la misma intensidad. Los electrófilos con electronegatividades más altas atraerán electrones mejor que aquellos con electronegatividades más bajas.[8]
1 Identificar electrófilos en los mecanismos de reacción de la química orgánica. La palabra electrófilo se refiere a especies "amantes de los electrones". Esto se aplica a átomos, moléculas e iones. Si puede aceptar un par de electrones, se lo considera un electrófilo. Solo recuerda que no todos los electrófilos atraen electrones con la misma intensidad. Los electrófilos con electronegatividades más altas atraerán electrones mejor que aquellos con electronegatividades más bajas.[8] - Los cationes son buenos ejemplos de electrófilos. Como tienen una carga neta positiva, se sienten atraídos por la carga negativa de un electrón. Los halógenos (cloro, flúor, etc.) también son fuertes electrófilos, ya que la adquisición de un electrón llenará su capa de electrones más externa, haciéndolos más estables en general.
-
 2 Identificar nucleófilos en los mecanismos de reacción de la química orgánica. Los nucleófilos son el complemento perfecto para los electrófilos. Un nucleófilo es cualquier especie que es capaz de donar un par de electrones. Las especies con electronegatividades más bajas serán más capaces de donar electrones, por lo que son mejores nucleófilos que las especies con mayor electronegatividades.[9]
2 Identificar nucleófilos en los mecanismos de reacción de la química orgánica. Los nucleófilos son el complemento perfecto para los electrófilos. Un nucleófilo es cualquier especie que es capaz de donar un par de electrones. Las especies con electronegatividades más bajas serán más capaces de donar electrones, por lo que son mejores nucleófilos que las especies con mayor electronegatividades.[9] - Los aniones cuentan con una carga negativa en general, y con frecuencia son capaces de abandonar los electrones para volverse más estables. Esto generalmente ocurre a través de enlaces iónicos. Los metales de la tierra alcalina, como el sodio, también tienden a ser de naturaleza nucleófila, ya que el dar un electrón estabilizará su capa exterior de electrones.
-
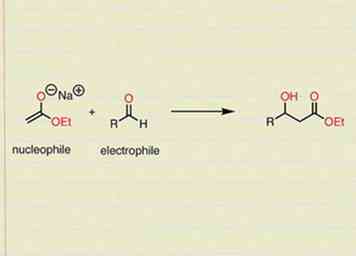 3 Recuerde que los nucleófilos atacan electrófilos en reacciones orgánicas. Esto es, en esencia, solo una forma de mirar los mecanismos consistentemente. Debería leer su mecanismo como si el compuesto nucleofílico buscara y reaccionara con el compuesto electrofílico. Esto te ayudará a recordar por dónde empezar y hacia dónde van los electrones.
3 Recuerde que los nucleófilos atacan electrófilos en reacciones orgánicas. Esto es, en esencia, solo una forma de mirar los mecanismos consistentemente. Debería leer su mecanismo como si el compuesto nucleofílico buscara y reaccionara con el compuesto electrofílico. Esto te ayudará a recordar por dónde empezar y hacia dónde van los electrones. - Un ejemplo de esto podría ser que tiene una molécula que contiene un doble enlace entre dos de sus carbonos (los electrones pi generalmente pueden formar otro enlace con una nueva especie), y una molécula de bromo (halógeno) ataca ese doble enlace.El resultado sería que el doble enlace se rompería, y el bromo se agregaría a uno de los dos carbonos (que el carbono depende de las condiciones y el tipo de reacción).
-
 4 Familiarícese con otros fundamentos de la química orgánica. Si bien la química orgánica es un gran tema, existen importantes principios subyacentes que rigen las reacciones más complejas. Si te familiarizas con estos principios y entiendes sus aplicaciones, podrás ver cómo se desarrollan en el conjunto más complejo de reacciones orgánicas. Algunas de las fundaciones más importantes son:[10]
4 Familiarícese con otros fundamentos de la química orgánica. Si bien la química orgánica es un gran tema, existen importantes principios subyacentes que rigen las reacciones más complejas. Si te familiarizas con estos principios y entiendes sus aplicaciones, podrás ver cómo se desarrollan en el conjunto más complejo de reacciones orgánicas. Algunas de las fundaciones más importantes son:[10] - Estereoquímica: se refiere a la forma en que la forma y el tamaño de una molécula afectan su reactividad.[11]
- Resonancia: es cuando una molécula tiene diferentes configuraciones de electrones posibles. Por ejemplo, un par de electrones podría encontrarse en un doble enlace o en un cierre por grupo funcional. Esta flexibilidad proporciona estabilización para la molécula.[12]
- Aromatización: esto lleva a la deslocalización de los electrones observados en resonancia (la capacidad de los electrones para compartirse a través de la molécula) a un nivel diferente. En una molécula aromática siempre hay electrones (4n + 2) pi y están deslocalizados a través de un sistema de enlace pi conjugado o en un anillo (como el benceno).[13]
- Grupos funcionales: estos grupos de átomos son responsables de las diferentes características de las moléculas a las que están unidos.
Parte tres de tres:
Estudiando Materiales de Química Orgánica Efectivamente
-
 1 Lee el libro antes de venir a clase. Esto le permitirá obtener una vista previa de la información que se tratará en las conferencias. Debe tomar notas sobre lo que lee y asegurarse de que se correspondan con las notas que toma durante la conferencia. También debe anotar cualquier pregunta que tenga mientras lee, y preguntarle si la conferencia no responde por usted.
1 Lee el libro antes de venir a clase. Esto le permitirá obtener una vista previa de la información que se tratará en las conferencias. Debe tomar notas sobre lo que lee y asegurarse de que se correspondan con las notas que toma durante la conferencia. También debe anotar cualquier pregunta que tenga mientras lee, y preguntarle si la conferencia no responde por usted. -
 2 Haga tarjetas de notas para diferentes reacciones orgánicas. Se beneficiará enormemente al dividir las grandes cantidades de información cubiertas en una clase de química orgánica en tarjetas de notas. El sistema que use para sus tarjetas de notas dependerá de la información que desee aprender en ese momento. No tires tus tarjetas de notas. Haga que revisen cada semana, y será mucho mejor para el examen final.[14]
2 Haga tarjetas de notas para diferentes reacciones orgánicas. Se beneficiará enormemente al dividir las grandes cantidades de información cubiertas en una clase de química orgánica en tarjetas de notas. El sistema que use para sus tarjetas de notas dependerá de la información que desee aprender en ese momento. No tires tus tarjetas de notas. Haga que revisen cada semana, y será mucho mejor para el examen final.[14] - Por ejemplo, podría hacer un conjunto de tarjetas de notas para una serie de reacciones de adición que esté estudiando. Del mismo modo, podría hacer un conjunto de tarjetas que cubran los diferentes tipos de reacciones (adición, eliminación, sustitución, etc.). Puede hacer varios juegos de tarjetas de nota, como las dos mencionadas, que organizan la información de diferentes maneras.
-
 3 Estudie química orgánica todos los días del semestre. La investigación muestra que concentrar todos tus estudios en una sesión masiva no es muy efectivo. Aprenderá mucho más si extiende su tiempo de estudio. Recuerde tomar un descanso para estudiar cada cuarenta y cinco minutos para descansar el cerebro.[15]
3 Estudie química orgánica todos los días del semestre. La investigación muestra que concentrar todos tus estudios en una sesión masiva no es muy efectivo. Aprenderá mucho más si extiende su tiempo de estudio. Recuerde tomar un descanso para estudiar cada cuarenta y cinco minutos para descansar el cerebro.[15] - Asegúrese de volver atrás y revisar material material pasado cada semana. Esto mantendrá el material fresco y se puede hacer fácilmente al revisar sus tarjetas de notas.
-
 4 Pase tiempo estudiando en grupo. Incluso si prefiere estudiar solo, a es donde descubrirá diferentes maneras de ver las reacciones orgánicas. Otros estudiantes pueden ser excelentes para determinar qué reacciones son SN1 o SN2, mientras que usted es mejor para identificar nucleófilos y electrófilos. Este intercambio de conocimiento beneficiará a todos.[16]
4 Pase tiempo estudiando en grupo. Incluso si prefiere estudiar solo, a es donde descubrirá diferentes maneras de ver las reacciones orgánicas. Otros estudiantes pueden ser excelentes para determinar qué reacciones son SN1 o SN2, mientras que usted es mejor para identificar nucleófilos y electrófilos. Este intercambio de conocimiento beneficiará a todos.[16] - Otra forma de acercarse al aprendizaje social es dar clases particulares a otra persona o encontrar un tutor usted mismo.
-
 5 Toma en serio los problemas de práctica. Trabajar a través de problemas de práctica obligará a su cerebro a recordar la información que ha aprendido. Esta es una habilidad vital para tomar la prueba. También es una buena idea cronometrarte para poder acelerar los problemas de trabajo. Intente tomar exámenes de práctica y trabaje en completarlos en la misma cantidad de tiempo que tendrá en clase.[17]
5 Toma en serio los problemas de práctica. Trabajar a través de problemas de práctica obligará a su cerebro a recordar la información que ha aprendido. Esta es una habilidad vital para tomar la prueba. También es una buena idea cronometrarte para poder acelerar los problemas de trabajo. Intente tomar exámenes de práctica y trabaje en completarlos en la misma cantidad de tiempo que tendrá en clase.[17]
 Minotauromaquia
Minotauromaquia
 1 Busque un mayor número de enlaces sigma para identificar reacciones de adición. En otras palabras, busque un mayor número de átomos que en la molécula original. Esto normalmente se permite al romper un enlace pi o unirse a un conjunto de electrones desapareados en la molécula. Las reacciones de adición no "intercambian" un átomo o grupo por otro. Simplemente agregan algo nuevo.[1]
1 Busque un mayor número de enlaces sigma para identificar reacciones de adición. En otras palabras, busque un mayor número de átomos que en la molécula original. Esto normalmente se permite al romper un enlace pi o unirse a un conjunto de electrones desapareados en la molécula. Las reacciones de adición no "intercambian" un átomo o grupo por otro. Simplemente agregan algo nuevo.[1]  2 Busque un mayor número de enlaces pi para indicar reacciones de eliminación. Esto es lo opuesto a una reacción de adición. Algo será quitado de la molécula original y dejará atrás electrones. Estos electrones no ligados aparecerán como un par solitario o formarán un enlace pi en la molécula.[2]
2 Busque un mayor número de enlaces pi para indicar reacciones de eliminación. Esto es lo opuesto a una reacción de adición. Algo será quitado de la molécula original y dejará atrás electrones. Estos electrones no ligados aparecerán como un par solitario o formarán un enlace pi en la molécula.[2]  3 Observe cualquier "intercambio" molecular para seleccionar reacciones de sustitución. Se produce una reacción de sustitución cuando se elimina un grupo (A) de la molécula y se reemplaza por un nuevo grupo (B). Esto no necesariamente cambia la cantidad de enlaces pi o sigma en la molécula, como vería con las reacciones de adición y eliminación. Los tipos comunes de reacciones de sustitución son:[3]
3 Observe cualquier "intercambio" molecular para seleccionar reacciones de sustitución. Se produce una reacción de sustitución cuando se elimina un grupo (A) de la molécula y se reemplaza por un nuevo grupo (B). Esto no necesariamente cambia la cantidad de enlaces pi o sigma en la molécula, como vería con las reacciones de adición y eliminación. Los tipos comunes de reacciones de sustitución son:[3]  4 Ubique las reacciones de reordenamiento cuando el producto tenga la misma fórmula que la molécula original. Los reordenamientos forman isómeros: moléculas que tienen exactamente los mismos átomos presentes pero en una configuración diferente. Los isómeros tendrán la misma fórmula química, pero diferentes propiedades que son exclusivas de su configuración. El número de enlaces generalmente no se ve afectado en los reordenamientos, también.[6]
4 Ubique las reacciones de reordenamiento cuando el producto tenga la misma fórmula que la molécula original. Los reordenamientos forman isómeros: moléculas que tienen exactamente los mismos átomos presentes pero en una configuración diferente. Los isómeros tendrán la misma fórmula química, pero diferentes propiedades que son exclusivas de su configuración. El número de enlaces generalmente no se ve afectado en los reordenamientos, también.[6]  5 Considere otras reacciones importantes que pueden afectar las moléculas orgánicas. Las reacciones de oxidación-reducción (o redox) son muy comunes en la química orgánica, al igual que las reacciones radicales. Deberías estar un poco familiarizado con estas reacciones de la química inorgánica general, pero es una buena idea revisarlas.[7]
5 Considere otras reacciones importantes que pueden afectar las moléculas orgánicas. Las reacciones de oxidación-reducción (o redox) son muy comunes en la química orgánica, al igual que las reacciones radicales. Deberías estar un poco familiarizado con estas reacciones de la química inorgánica general, pero es una buena idea revisarlas.[7]  1 Identificar electrófilos en los mecanismos de reacción de la química orgánica. La palabra electrófilo se refiere a especies "amantes de los electrones". Esto se aplica a átomos, moléculas e iones. Si puede aceptar un par de electrones, se lo considera un electrófilo. Solo recuerda que no todos los electrófilos atraen electrones con la misma intensidad. Los electrófilos con electronegatividades más altas atraerán electrones mejor que aquellos con electronegatividades más bajas.[8]
1 Identificar electrófilos en los mecanismos de reacción de la química orgánica. La palabra electrófilo se refiere a especies "amantes de los electrones". Esto se aplica a átomos, moléculas e iones. Si puede aceptar un par de electrones, se lo considera un electrófilo. Solo recuerda que no todos los electrófilos atraen electrones con la misma intensidad. Los electrófilos con electronegatividades más altas atraerán electrones mejor que aquellos con electronegatividades más bajas.[8]  2 Identificar nucleófilos en los mecanismos de reacción de la química orgánica. Los nucleófilos son el complemento perfecto para los electrófilos. Un nucleófilo es cualquier especie que es capaz de donar un par de electrones. Las especies con electronegatividades más bajas serán más capaces de donar electrones, por lo que son mejores nucleófilos que las especies con mayor electronegatividades.[9]
2 Identificar nucleófilos en los mecanismos de reacción de la química orgánica. Los nucleófilos son el complemento perfecto para los electrófilos. Un nucleófilo es cualquier especie que es capaz de donar un par de electrones. Las especies con electronegatividades más bajas serán más capaces de donar electrones, por lo que son mejores nucleófilos que las especies con mayor electronegatividades.[9]  3 Recuerde que los nucleófilos atacan electrófilos en reacciones orgánicas. Esto es, en esencia, solo una forma de mirar los mecanismos consistentemente. Debería leer su mecanismo como si el compuesto nucleofílico buscara y reaccionara con el compuesto electrofílico. Esto te ayudará a recordar por dónde empezar y hacia dónde van los electrones.
3 Recuerde que los nucleófilos atacan electrófilos en reacciones orgánicas. Esto es, en esencia, solo una forma de mirar los mecanismos consistentemente. Debería leer su mecanismo como si el compuesto nucleofílico buscara y reaccionara con el compuesto electrofílico. Esto te ayudará a recordar por dónde empezar y hacia dónde van los electrones.  4 Familiarícese con otros fundamentos de la química orgánica. Si bien la química orgánica es un gran tema, existen importantes principios subyacentes que rigen las reacciones más complejas. Si te familiarizas con estos principios y entiendes sus aplicaciones, podrás ver cómo se desarrollan en el conjunto más complejo de reacciones orgánicas. Algunas de las fundaciones más importantes son:[10]
4 Familiarícese con otros fundamentos de la química orgánica. Si bien la química orgánica es un gran tema, existen importantes principios subyacentes que rigen las reacciones más complejas. Si te familiarizas con estos principios y entiendes sus aplicaciones, podrás ver cómo se desarrollan en el conjunto más complejo de reacciones orgánicas. Algunas de las fundaciones más importantes son:[10]  1 Lee el libro antes de venir a clase. Esto le permitirá obtener una vista previa de la información que se tratará en las conferencias. Debe tomar notas sobre lo que lee y asegurarse de que se correspondan con las notas que toma durante la conferencia. También debe anotar cualquier pregunta que tenga mientras lee, y preguntarle si la conferencia no responde por usted.
1 Lee el libro antes de venir a clase. Esto le permitirá obtener una vista previa de la información que se tratará en las conferencias. Debe tomar notas sobre lo que lee y asegurarse de que se correspondan con las notas que toma durante la conferencia. También debe anotar cualquier pregunta que tenga mientras lee, y preguntarle si la conferencia no responde por usted.  2 Haga tarjetas de notas para diferentes reacciones orgánicas. Se beneficiará enormemente al dividir las grandes cantidades de información cubiertas en una clase de química orgánica en tarjetas de notas. El sistema que use para sus tarjetas de notas dependerá de la información que desee aprender en ese momento. No tires tus tarjetas de notas. Haga que revisen cada semana, y será mucho mejor para el examen final.[14]
2 Haga tarjetas de notas para diferentes reacciones orgánicas. Se beneficiará enormemente al dividir las grandes cantidades de información cubiertas en una clase de química orgánica en tarjetas de notas. El sistema que use para sus tarjetas de notas dependerá de la información que desee aprender en ese momento. No tires tus tarjetas de notas. Haga que revisen cada semana, y será mucho mejor para el examen final.[14]  3 Estudie química orgánica todos los días del semestre. La investigación muestra que concentrar todos tus estudios en una sesión masiva no es muy efectivo. Aprenderá mucho más si extiende su tiempo de estudio. Recuerde tomar un descanso para estudiar cada cuarenta y cinco minutos para descansar el cerebro.[15]
3 Estudie química orgánica todos los días del semestre. La investigación muestra que concentrar todos tus estudios en una sesión masiva no es muy efectivo. Aprenderá mucho más si extiende su tiempo de estudio. Recuerde tomar un descanso para estudiar cada cuarenta y cinco minutos para descansar el cerebro.[15]  4 Pase tiempo estudiando en grupo. Incluso si prefiere estudiar solo, a es donde descubrirá diferentes maneras de ver las reacciones orgánicas. Otros estudiantes pueden ser excelentes para determinar qué reacciones son SN1 o SN2, mientras que usted es mejor para identificar nucleófilos y electrófilos. Este intercambio de conocimiento beneficiará a todos.[16]
4 Pase tiempo estudiando en grupo. Incluso si prefiere estudiar solo, a es donde descubrirá diferentes maneras de ver las reacciones orgánicas. Otros estudiantes pueden ser excelentes para determinar qué reacciones son SN1 o SN2, mientras que usted es mejor para identificar nucleófilos y electrófilos. Este intercambio de conocimiento beneficiará a todos.[16]  5 Toma en serio los problemas de práctica. Trabajar a través de problemas de práctica obligará a su cerebro a recordar la información que ha aprendido. Esta es una habilidad vital para tomar la prueba. También es una buena idea cronometrarte para poder acelerar los problemas de trabajo. Intente tomar exámenes de práctica y trabaje en completarlos en la misma cantidad de tiempo que tendrá en clase.[17]
5 Toma en serio los problemas de práctica. Trabajar a través de problemas de práctica obligará a su cerebro a recordar la información que ha aprendido. Esta es una habilidad vital para tomar la prueba. También es una buena idea cronometrarte para poder acelerar los problemas de trabajo. Intente tomar exámenes de práctica y trabaje en completarlos en la misma cantidad de tiempo que tendrá en clase.[17]