La Química Orgánica tiene una reputación desagradable: no es raro que los estudiantes escuchen historias de terror sobre la dificultad de la clase antes de que puedan tomarla ellos mismos. Si bien la clase puede ser desafiante, "O Chem" no es la pesadilla que a menudo se cree. Hay menos información para memorizar pero más procesos para comprender, por lo que una comprensión de los fundamentos y un buen régimen de estudio son clave para obtener una calificación aprobatoria.
Parte uno de tres:
Conocimiento básico de O Chem
-
 1 Aprenda la definición de "química orgánica"."En términos generales, la química orgánica es el estudio de compuestos químicos a base de carbono.[1] El carbono es el sexto elemento en la tabla periódica y uno de los elementos fundamentales para la vida en la tierra. Los seres vivos están formados por moléculas hechas principalmente de carbono. Esto significa que O chem incluye la química que ocurre dentro de su cuerpo todos los días. También incluye la química que ocurre dentro de los animales, las plantas y los ecosistemas naturales.
1 Aprenda la definición de "química orgánica"."En términos generales, la química orgánica es el estudio de compuestos químicos a base de carbono.[1] El carbono es el sexto elemento en la tabla periódica y uno de los elementos fundamentales para la vida en la tierra. Los seres vivos están formados por moléculas hechas principalmente de carbono. Esto significa que O chem incluye la química que ocurre dentro de su cuerpo todos los días. También incluye la química que ocurre dentro de los animales, las plantas y los ecosistemas naturales. - Sin embargo, la química orgánica no se limita a los seres vivos. Por ejemplo, las reacciones químicas involucradas en la quema de combustibles fósiles caen bajo el paraguas O chem porque estas reacciones involucran compuestos a base de carbono en los combustibles.
-
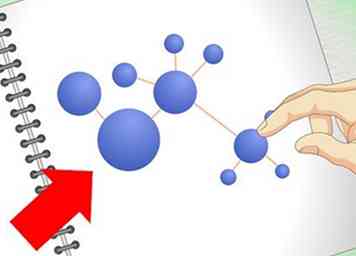 2 Aprende las formas comunes de representar moléculas. O chem es un área de estudio más "visual" que la química general. Confiarás en dibujos de moléculas y compuestos con más frecuencia que en clases de química anteriores. Saber cómo interpretar este tipo de representaciones visuales es una de las habilidades químicas más básicas e importantes.
2 Aprende las formas comunes de representar moléculas. O chem es un área de estudio más "visual" que la química general. Confiarás en dibujos de moléculas y compuestos con más frecuencia que en clases de química anteriores. Saber cómo interpretar este tipo de representaciones visuales es una de las habilidades químicas más básicas e importantes. - Tendrá que estar familiarizado con las estructuras de Lewis antes de comenzar. Estos generalmente se enseñan como parte de un curso de química general. En una estructura de Lewis, los átomos en una molécula están representados por su símbolo químico (sus letras en la tabla periódica). Las líneas representan los enlaces entre ellas y los puntos representan sus electrones de valencia. Vea nuestro artículo de la estructura de Lewis para un repaso.
- Una forma de dibujar moléculas que probablemente sean nuevas para usted es la fórmula esquelética método. En una fórmula esquelética (también llamada "estructura de línea de unión"), no se muestran los átomos de carbono. En cambio, solo hay una línea para representar el vínculo. Como hay tantos átomos de carbono en O chem, esto hace que sea mucho más rápido extraer moléculas. Los átomos que no son carbono todavía están representados por sus símbolos químicos. Una buena guía de formaciones esqueléticas está disponible aquí.[2]
-
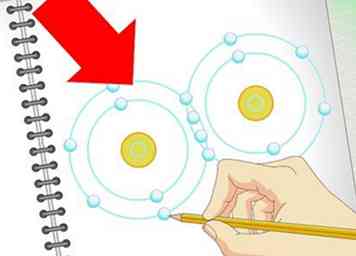 3 Aprenda cómo representar los enlaces. Covalente los bonos son con mucho el tipo más común de bonos con los que tratará en O chem (aunque el conocimiento de los enlaces iónicos, etc. aún es valioso). En un enlace covalente, dos átomos comparten electrones desapareados para formar un enlace. Si hay electrones desemparejados adicionales disponibles, son posibles átomos de doble o triple enlace.
3 Aprenda cómo representar los enlaces. Covalente los bonos son con mucho el tipo más común de bonos con los que tratará en O chem (aunque el conocimiento de los enlaces iónicos, etc. aún es valioso). En un enlace covalente, dos átomos comparten electrones desapareados para formar un enlace. Si hay electrones desemparejados adicionales disponibles, son posibles átomos de doble o triple enlace. - Tanto en las estructuras de Lewis como en las fórmulas esqueléticas, los enlaces simples están representados por una línea, las líneas dobles por una línea doble y los enlaces triples por una línea triple.
- En las fórmulas esqueléticas, los enlaces entre los átomos de carbono (C) e hidrógeno (H) generalmente no se dibujan porque son muy comunes.
- Excepto en circunstancias especiales, normalmente solo se les permite a los átomos tener ocho electrones de valencia (capa externa). Esto significa que la mayoría de las veces un átomo puede unirse a un máximo de otros cuatro átomos.
-
 4 Aprende los conceptos básicos de la estructura molecular tridimensional. La química orgánica requiere que los estudiantes piensen en las moléculas químicas de la forma en que actualmente existen en la vida real, no solo la forma en que se dibujan. Las moléculas toman la forma de estructuras tridimensionales. La naturaleza de los enlaces en la molécula es lo más importante para determinar la forma tridimensional de una molécula, aunque otros factores también pueden desempeñar un papel. A continuación hay algunas cosas para recordar cuando se trata de las formas de las moléculas basadas en carbono:
4 Aprende los conceptos básicos de la estructura molecular tridimensional. La química orgánica requiere que los estudiantes piensen en las moléculas químicas de la forma en que actualmente existen en la vida real, no solo la forma en que se dibujan. Las moléculas toman la forma de estructuras tridimensionales. La naturaleza de los enlaces en la molécula es lo más importante para determinar la forma tridimensional de una molécula, aunque otros factores también pueden desempeñar un papel. A continuación hay algunas cosas para recordar cuando se trata de las formas de las moléculas basadas en carbono: - Un carbono unido a otros cuatro átomos con enlaces simples tendrá la forma de un tetraedro (pirámide de cuatro puntas). Un buen ejemplo de esto es la molécula metano (CH4)
- Un carbono unido a otro átomo con un doble enlace y dos átomos con enlaces simples tiene un trigonal plana (triángulo plano) forma. El ion CO3-2 es un buen ejemplo aquí.
- Un carbono unido a dos átomos con dobles enlaces o unido a un álbum con un enlace triple tiene una lineal (línea rígida) forma. La molécula de dióxido de carbono (CO2) es un ejemplo.
-
 5 Aprenda a descifrar la hibridación orbital. Este tema tiene un nombre intimidante, pero no es ese difícil de entender. Esencialmente, orbitales híbridos son solo formas en que los químicos representan los electrones de valencia de un átomo en función de cómo se comporta ese átomo (más bien cómo se dibuja). Si un átomo tiene una cierta cantidad de electrones desapareados disponibles para la unión, pero tiende a formar un número diferente de enlaces, se dice que tiene "orbitales híbridos" para compensar la diferencia.
5 Aprenda a descifrar la hibridación orbital. Este tema tiene un nombre intimidante, pero no es ese difícil de entender. Esencialmente, orbitales híbridos son solo formas en que los químicos representan los electrones de valencia de un átomo en función de cómo se comporta ese átomo (más bien cómo se dibuja). Si un átomo tiene una cierta cantidad de electrones desapareados disponibles para la unión, pero tiende a formar un número diferente de enlaces, se dice que tiene "orbitales híbridos" para compensar la diferencia. - El carbono es un ejemplo perfecto de esto. Los átomos de carbono tienen cuatro electrones de valencia: dos en el orbital 2s y dos desapareados en el orbital 2p. Como hay dos electrones desapareados, se puede esperar que el carbono forme dos enlaces. Sin embargo, los experimentos muestran que los electrones apareados en el orbital 2s forman enlaces a pesar de que no están desapareados. Por lo tanto, decimos que el átomo de carbono tiene cuatro electrones desapareados en un orbital híbrido sp.
-
 6 Aprenda los conceptos básicos de la electronegatividad. Hay muchos, muchos factores que pueden determinar cómo dos moléculas reaccionan entre sí en O chem. Sin embargo, la electronegatividad es a menudo uno de los factores más importantes. La electronegatividad es una forma de medir qué tan "apretado" tiene un átomo determinado sus electrones. Los átomos con alta electronegatividad tienden a mantener sus electrones fuertemente (y viceversa para los átomos con baja electronegatividad). Vea nuestro artículo de electronegatividad para obtener información detallada.
6 Aprenda los conceptos básicos de la electronegatividad. Hay muchos, muchos factores que pueden determinar cómo dos moléculas reaccionan entre sí en O chem. Sin embargo, la electronegatividad es a menudo uno de los factores más importantes. La electronegatividad es una forma de medir qué tan "apretado" tiene un átomo determinado sus electrones. Los átomos con alta electronegatividad tienden a mantener sus electrones fuertemente (y viceversa para los átomos con baja electronegatividad). Vea nuestro artículo de electronegatividad para obtener información detallada. - A medida que avanza arriba y hacia la derecha en la tabla periódica, los átomos ganan más electronegatividad (el hidrógeno y el helio no están incluidos). El flúor, el átomo en la parte superior superior derecha, tiene la electronegatividad más alta de todas.
- Debido a que los átomos electronegativos "quieren" más electrones, tienden a reaccionar al "agarrar" los electrones disponibles en otras moléculas. Por ejemplo, átomos como el cloro y el flúor a menudo aparecen como iones negativos porque han tomado electrones de otros átomos.[3]
Parte dos de tres:
Consejos de estudio
-
 1 No te intimides La química orgánica presenta una gran cantidad de conceptos nuevos y te obliga a pensar sobre los problemas de la química de nuevas maneras. Tendrás que aprender un nuevo "vocabulario" de química. Relájese: todos en su clase enfrentan los mismos desafíos. Estudie diligentemente y obtenga la ayuda que necesita y probablemente estará bien.
1 No te intimides La química orgánica presenta una gran cantidad de conceptos nuevos y te obliga a pensar sobre los problemas de la química de nuevas maneras. Tendrás que aprender un nuevo "vocabulario" de química. Relájese: todos en su clase enfrentan los mismos desafíos. Estudie diligentemente y obtenga la ayuda que necesita y probablemente estará bien. - No dejes que las historias de terror de personas que han tomado O chem antes te lleguen. Los estudiantes tienden a embellecer lo difícil que fueron sus experiencias. Entrar en tu primera prueba aterrado de que te enfrentas a un desafío imposible solo hará las cosas más difíciles.[4] En cambio, aumente su confianza al pasar mucho tiempo estudiando y descansando lo suficiente la noche anterior.
-
 2 Enfóquese en la comprensión en lugar de la memorización. Es probable que vea cientos de reacciones diferentes en su clase O chem. Es virtualmente imposible memorizarlos a todos, así que no pierdas el tiempo memorizando ninguno, sino el más importante. En cambio, concéntrese en el principios básicos detrás de las reacciones más comunes. La mayoría de las reacciones siguen uno de los pocos patrones, por lo que entender bien estos patrones y saber cómo aplicarlos es una forma mucho más eficiente de resolver los problemas.
2 Enfóquese en la comprensión en lugar de la memorización. Es probable que vea cientos de reacciones diferentes en su clase O chem. Es virtualmente imposible memorizarlos a todos, así que no pierdas el tiempo memorizando ninguno, sino el más importante. En cambio, concéntrese en el principios básicos detrás de las reacciones más comunes. La mayoría de las reacciones siguen uno de los pocos patrones, por lo que entender bien estos patrones y saber cómo aplicarlos es una forma mucho más eficiente de resolver los problemas. - Sin embargo, si eres bueno en la memorización, aún puedes usar esto para tu ventaja. Intenta escribir mecanismos de reacción básicos en tarjetas didácticas y úsalas para memorizar las reacciones. Todavía necesitará poder ajustar su conocimiento cuando vea reacciones con las que no está familiarizado, pero puede usar los principios básicos para guiarlo hacia el mecanismo correcto.
-
 3 Conoce tus grupos funcionales. Basic O chem utiliza el mismo conjunto de estructuras reactivas en casi todas sus moléculas. Estas estructuras se conocen como "grupos funcionales". Saber cómo identificar estos grupos funcionales y cómo tienden a reaccionar es crucial para muchas asignaciones O chem. Como los grupos funcionales generalmente reaccionan de la misma manera con consistencia, conocer sus rasgos le permite resolver una amplia variedad de problemas.
3 Conoce tus grupos funcionales. Basic O chem utiliza el mismo conjunto de estructuras reactivas en casi todas sus moléculas. Estas estructuras se conocen como "grupos funcionales". Saber cómo identificar estos grupos funcionales y cómo tienden a reaccionar es crucial para muchas asignaciones O chem. Como los grupos funcionales generalmente reaccionan de la misma manera con consistencia, conocer sus rasgos le permite resolver una amplia variedad de problemas. - Hay demasiados grupos funcionales en química orgánica para enumerarlos en este artículo. Sin embargo, no es difícil encontrar guías para los grupos funcionales en línea. Por ejemplo, una buena guía de la Universidad de Purdue está disponible aquí.
-
 4 En caso de duda, siga el flujo de electrones. En su nivel más básico, la mayoría de las reacciones de química orgánica solo involucran dos o más moléculas que intercambian electrones. Si no puede descubrir cómo iniciarse en un mecanismo de reacción, comience por buscar lugares donde tenga sentido que se transfieran los electrones. En otras palabras, busque átomos que parezcan especialmente buenos aceptadores de electrones y átomos que se vean como donantes de electrones especialmente buenos. Haga la transferencia y luego pregunte, "¿qué debo hacer ahora para que mis nuevas moléculas se estabilicen?"
4 En caso de duda, siga el flujo de electrones. En su nivel más básico, la mayoría de las reacciones de química orgánica solo involucran dos o más moléculas que intercambian electrones. Si no puede descubrir cómo iniciarse en un mecanismo de reacción, comience por buscar lugares donde tenga sentido que se transfieran los electrones. En otras palabras, busque átomos que parezcan especialmente buenos aceptadores de electrones y átomos que se vean como donantes de electrones especialmente buenos. Haga la transferencia y luego pregunte, "¿qué debo hacer ahora para que mis nuevas moléculas se estabilicen?" - Como ejemplo, dado que el oxígeno (O) es más electronegativo que el carbono, la O que está unida a C en un grupo de cetona tiende a mantener los electrones en el enlace más cerca de sí mismo. Esto le da a C una carga parcialmente positiva y lo convierte en un buen candidato para recibir electrones. Si tienes un buen donante de electrones involucrado en la reacción, tiene sentido que pueda atacar a la C, formando un nuevo vínculo y dando inicio a tu reacción.
-
 5 Use grupos de estudio para tareas y exámenes. Nunca sienta que necesita abordar la química orgánica por su cuenta. Reunirse para hacer su trabajo con sus compañeros es una idea fantástica. No solo los demás pueden ayudarlo con los conceptos con los que está luchando, sino que también puede obtener una comprensión más sólida del material que ya conoce explicándolo a otra persona.
5 Use grupos de estudio para tareas y exámenes. Nunca sienta que necesita abordar la química orgánica por su cuenta. Reunirse para hacer su trabajo con sus compañeros es una idea fantástica. No solo los demás pueden ayudarlo con los conceptos con los que está luchando, sino que también puede obtener una comprensión más sólida del material que ya conoce explicándolo a otra persona.
Parte tres de tres:
Obteniendo ayuda
-
 1 Conoce a tu profesor La persona con el mejor conocimiento de O chem en su clase es la persona que enseña la clase. Aproveche este valioso recurso. Visita la oficina de tu maestro para hablar sobre las áreas con las que tienes problemas. Trate de hacer algunas preguntas claras y sucintas, o un problema o dos con los que tenga problemas. Prepárate para explicar el proceso de pensamiento que te llevó a la respuesta incorrecta.
1 Conoce a tu profesor La persona con el mejor conocimiento de O chem en su clase es la persona que enseña la clase. Aproveche este valioso recurso. Visita la oficina de tu maestro para hablar sobre las áreas con las que tienes problemas. Trate de hacer algunas preguntas claras y sucintas, o un problema o dos con los que tenga problemas. Prepárate para explicar el proceso de pensamiento que te llevó a la respuesta incorrecta. - Evite entrar a la oficina de su profesor sin una idea clara de lo que quiere. Simplemente decir "No obtengo la tarea" no te proporcionará ayuda útil.
- No solo es una excelente manera de obtener respuestas a sus preguntas, sino que también puede ayudarlo a conocer a su profesor. Tenga en cuenta que si apunta a la escuela de posgrado, necesitará algunas referencias académicas en el futuro. Es mucho más probable que los profesores escriban positivamente sobre las personas que se tomaron el tiempo para hablar con ellos.
-
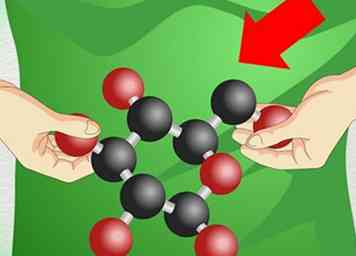 2 Use herramientas para ayudar a visualizar problemas. En O chem, las formas de las moléculas pueden determinar cómo reaccionan. Debido a que puede ser difícil representar moléculas 3D complejas en una hoja de papel plana, el uso de bloques de construcción físicos es una excelente manera de envolver su cabeza en estructuras difíciles.
2 Use herramientas para ayudar a visualizar problemas. En O chem, las formas de las moléculas pueden determinar cómo reaccionan. Debido a que puede ser difícil representar moléculas 3D complejas en una hoja de papel plana, el uso de bloques de construcción físicos es una excelente manera de envolver su cabeza en estructuras difíciles. - Los conjuntos de modelos moleculares le permiten construir moléculas a partir de piezas de plástico. Estos pueden ser un tanto caros si los compra en la librería de su escuela o en un proveedor de productos químicos, pero algunos profesores los prestarán a los estudiantes que los soliciten sin costo alguno.
- Si no puede obtener un conjunto de modelos "real", intente utilizar bolas de espuma, marcadores y tacos de madera en su tienda local de manualidades para obtener una alternativa de bricolaje.
- Varios programas de computadora (como el disponible aquí) también pueden ayudarlo a modelar moléculas en tres dimensiones.[5]
-
 3 Únase a la discusión en foros de ayuda. Uno de los revestimientos plateados del alto nivel de dificultad de la química O es que hay un montón de estudiantes que buscan ayuda en línea (además de ofrecerla). Varios foros de química en línea tienen grandes comunidades de usuarios dispuestos a discutir temas orgánicos difíciles. Intente publicar un problema con el que tenga problemas en uno de estos foros, luego trabaje con las personas que responden para obtener la ayuda que necesita.
3 Únase a la discusión en foros de ayuda. Uno de los revestimientos plateados del alto nivel de dificultad de la química O es que hay un montón de estudiantes que buscan ayuda en línea (además de ofrecerla). Varios foros de química en línea tienen grandes comunidades de usuarios dispuestos a discutir temas orgánicos difíciles. Intente publicar un problema con el que tenga problemas en uno de estos foros, luego trabaje con las personas que responden para obtener la ayuda que necesita. - Aunque hay muchos foros para este tipo de problemas, Chemicalforums.com es un buen lugar para comenzar.[6]
-
 4 Use los recursos de O chem en línea. Una amplia variedad de sitios puede ayudar con temas difíciles de O chem. A continuación se enumeran algunos buenos recursos:
4 Use los recursos de O chem en línea. Una amplia variedad de sitios puede ayudar con temas difíciles de O chem. A continuación se enumeran algunos buenos recursos: - Khan Academy: presenta numerosas video conferencias que cubren una variedad de temas básicos.[7]
- Chem Helper: tiene enlaces para practicar pruebas, foros de ayuda, mecanismos de reacción y más. También incluye ayuda de laboratorio.[8]
- Aiken de la Universidad de Carolina del Sur: incluye su propio directorio de sitios web útiles que cubren una variedad de temas de O chem.
 Minotauromaquia
Minotauromaquia
 1 Aprenda la definición de "química orgánica"."En términos generales, la química orgánica es el estudio de compuestos químicos a base de carbono.[1] El carbono es el sexto elemento en la tabla periódica y uno de los elementos fundamentales para la vida en la tierra. Los seres vivos están formados por moléculas hechas principalmente de carbono. Esto significa que O chem incluye la química que ocurre dentro de su cuerpo todos los días. También incluye la química que ocurre dentro de los animales, las plantas y los ecosistemas naturales.
1 Aprenda la definición de "química orgánica"."En términos generales, la química orgánica es el estudio de compuestos químicos a base de carbono.[1] El carbono es el sexto elemento en la tabla periódica y uno de los elementos fundamentales para la vida en la tierra. Los seres vivos están formados por moléculas hechas principalmente de carbono. Esto significa que O chem incluye la química que ocurre dentro de su cuerpo todos los días. También incluye la química que ocurre dentro de los animales, las plantas y los ecosistemas naturales.  2 Aprende las formas comunes de representar moléculas. O chem es un área de estudio más "visual" que la química general. Confiarás en dibujos de moléculas y compuestos con más frecuencia que en clases de química anteriores. Saber cómo interpretar este tipo de representaciones visuales es una de las habilidades químicas más básicas e importantes.
2 Aprende las formas comunes de representar moléculas. O chem es un área de estudio más "visual" que la química general. Confiarás en dibujos de moléculas y compuestos con más frecuencia que en clases de química anteriores. Saber cómo interpretar este tipo de representaciones visuales es una de las habilidades químicas más básicas e importantes.  3 Aprenda cómo representar los enlaces. Covalente los bonos son con mucho el tipo más común de bonos con los que tratará en O chem (aunque el conocimiento de los enlaces iónicos, etc. aún es valioso). En un enlace covalente, dos átomos comparten electrones desapareados para formar un enlace. Si hay electrones desemparejados adicionales disponibles, son posibles átomos de doble o triple enlace.
3 Aprenda cómo representar los enlaces. Covalente los bonos son con mucho el tipo más común de bonos con los que tratará en O chem (aunque el conocimiento de los enlaces iónicos, etc. aún es valioso). En un enlace covalente, dos átomos comparten electrones desapareados para formar un enlace. Si hay electrones desemparejados adicionales disponibles, son posibles átomos de doble o triple enlace.  4 Aprende los conceptos básicos de la estructura molecular tridimensional. La química orgánica requiere que los estudiantes piensen en las moléculas químicas de la forma en que actualmente existen en la vida real, no solo la forma en que se dibujan. Las moléculas toman la forma de estructuras tridimensionales. La naturaleza de los enlaces en la molécula es lo más importante para determinar la forma tridimensional de una molécula, aunque otros factores también pueden desempeñar un papel. A continuación hay algunas cosas para recordar cuando se trata de las formas de las moléculas basadas en carbono:
4 Aprende los conceptos básicos de la estructura molecular tridimensional. La química orgánica requiere que los estudiantes piensen en las moléculas químicas de la forma en que actualmente existen en la vida real, no solo la forma en que se dibujan. Las moléculas toman la forma de estructuras tridimensionales. La naturaleza de los enlaces en la molécula es lo más importante para determinar la forma tridimensional de una molécula, aunque otros factores también pueden desempeñar un papel. A continuación hay algunas cosas para recordar cuando se trata de las formas de las moléculas basadas en carbono:  5 Aprenda a descifrar la hibridación orbital. Este tema tiene un nombre intimidante, pero no es ese difícil de entender. Esencialmente, orbitales híbridos son solo formas en que los químicos representan los electrones de valencia de un átomo en función de cómo se comporta ese átomo (más bien cómo se dibuja). Si un átomo tiene una cierta cantidad de electrones desapareados disponibles para la unión, pero tiende a formar un número diferente de enlaces, se dice que tiene "orbitales híbridos" para compensar la diferencia.
5 Aprenda a descifrar la hibridación orbital. Este tema tiene un nombre intimidante, pero no es ese difícil de entender. Esencialmente, orbitales híbridos son solo formas en que los químicos representan los electrones de valencia de un átomo en función de cómo se comporta ese átomo (más bien cómo se dibuja). Si un átomo tiene una cierta cantidad de electrones desapareados disponibles para la unión, pero tiende a formar un número diferente de enlaces, se dice que tiene "orbitales híbridos" para compensar la diferencia.  6 Aprenda los conceptos básicos de la electronegatividad. Hay muchos, muchos factores que pueden determinar cómo dos moléculas reaccionan entre sí en O chem. Sin embargo, la electronegatividad es a menudo uno de los factores más importantes. La electronegatividad es una forma de medir qué tan "apretado" tiene un átomo determinado sus electrones. Los átomos con alta electronegatividad tienden a mantener sus electrones fuertemente (y viceversa para los átomos con baja electronegatividad). Vea nuestro artículo de electronegatividad para obtener información detallada.
6 Aprenda los conceptos básicos de la electronegatividad. Hay muchos, muchos factores que pueden determinar cómo dos moléculas reaccionan entre sí en O chem. Sin embargo, la electronegatividad es a menudo uno de los factores más importantes. La electronegatividad es una forma de medir qué tan "apretado" tiene un átomo determinado sus electrones. Los átomos con alta electronegatividad tienden a mantener sus electrones fuertemente (y viceversa para los átomos con baja electronegatividad). Vea nuestro artículo de electronegatividad para obtener información detallada.  1 No te intimides La química orgánica presenta una gran cantidad de conceptos nuevos y te obliga a pensar sobre los problemas de la química de nuevas maneras. Tendrás que aprender un nuevo "vocabulario" de química. Relájese: todos en su clase enfrentan los mismos desafíos. Estudie diligentemente y obtenga la ayuda que necesita y probablemente estará bien.
1 No te intimides La química orgánica presenta una gran cantidad de conceptos nuevos y te obliga a pensar sobre los problemas de la química de nuevas maneras. Tendrás que aprender un nuevo "vocabulario" de química. Relájese: todos en su clase enfrentan los mismos desafíos. Estudie diligentemente y obtenga la ayuda que necesita y probablemente estará bien.  2 Enfóquese en la comprensión en lugar de la memorización. Es probable que vea cientos de reacciones diferentes en su clase O chem. Es virtualmente imposible memorizarlos a todos, así que no pierdas el tiempo memorizando ninguno, sino el más importante. En cambio, concéntrese en el principios básicos detrás de las reacciones más comunes. La mayoría de las reacciones siguen uno de los pocos patrones, por lo que entender bien estos patrones y saber cómo aplicarlos es una forma mucho más eficiente de resolver los problemas.
2 Enfóquese en la comprensión en lugar de la memorización. Es probable que vea cientos de reacciones diferentes en su clase O chem. Es virtualmente imposible memorizarlos a todos, así que no pierdas el tiempo memorizando ninguno, sino el más importante. En cambio, concéntrese en el principios básicos detrás de las reacciones más comunes. La mayoría de las reacciones siguen uno de los pocos patrones, por lo que entender bien estos patrones y saber cómo aplicarlos es una forma mucho más eficiente de resolver los problemas.  3 Conoce tus grupos funcionales. Basic O chem utiliza el mismo conjunto de estructuras reactivas en casi todas sus moléculas. Estas estructuras se conocen como "grupos funcionales". Saber cómo identificar estos grupos funcionales y cómo tienden a reaccionar es crucial para muchas asignaciones O chem. Como los grupos funcionales generalmente reaccionan de la misma manera con consistencia, conocer sus rasgos le permite resolver una amplia variedad de problemas.
3 Conoce tus grupos funcionales. Basic O chem utiliza el mismo conjunto de estructuras reactivas en casi todas sus moléculas. Estas estructuras se conocen como "grupos funcionales". Saber cómo identificar estos grupos funcionales y cómo tienden a reaccionar es crucial para muchas asignaciones O chem. Como los grupos funcionales generalmente reaccionan de la misma manera con consistencia, conocer sus rasgos le permite resolver una amplia variedad de problemas.  4 En caso de duda, siga el flujo de electrones. En su nivel más básico, la mayoría de las reacciones de química orgánica solo involucran dos o más moléculas que intercambian electrones. Si no puede descubrir cómo iniciarse en un mecanismo de reacción, comience por buscar lugares donde tenga sentido que se transfieran los electrones. En otras palabras, busque átomos que parezcan especialmente buenos aceptadores de electrones y átomos que se vean como donantes de electrones especialmente buenos. Haga la transferencia y luego pregunte, "¿qué debo hacer ahora para que mis nuevas moléculas se estabilicen?"
4 En caso de duda, siga el flujo de electrones. En su nivel más básico, la mayoría de las reacciones de química orgánica solo involucran dos o más moléculas que intercambian electrones. Si no puede descubrir cómo iniciarse en un mecanismo de reacción, comience por buscar lugares donde tenga sentido que se transfieran los electrones. En otras palabras, busque átomos que parezcan especialmente buenos aceptadores de electrones y átomos que se vean como donantes de electrones especialmente buenos. Haga la transferencia y luego pregunte, "¿qué debo hacer ahora para que mis nuevas moléculas se estabilicen?"  5 Use grupos de estudio para tareas y exámenes. Nunca sienta que necesita abordar la química orgánica por su cuenta. Reunirse para hacer su trabajo con sus compañeros es una idea fantástica. No solo los demás pueden ayudarlo con los conceptos con los que está luchando, sino que también puede obtener una comprensión más sólida del material que ya conoce explicándolo a otra persona.
5 Use grupos de estudio para tareas y exámenes. Nunca sienta que necesita abordar la química orgánica por su cuenta. Reunirse para hacer su trabajo con sus compañeros es una idea fantástica. No solo los demás pueden ayudarlo con los conceptos con los que está luchando, sino que también puede obtener una comprensión más sólida del material que ya conoce explicándolo a otra persona.  1 Conoce a tu profesor La persona con el mejor conocimiento de O chem en su clase es la persona que enseña la clase. Aproveche este valioso recurso. Visita la oficina de tu maestro para hablar sobre las áreas con las que tienes problemas. Trate de hacer algunas preguntas claras y sucintas, o un problema o dos con los que tenga problemas. Prepárate para explicar el proceso de pensamiento que te llevó a la respuesta incorrecta.
1 Conoce a tu profesor La persona con el mejor conocimiento de O chem en su clase es la persona que enseña la clase. Aproveche este valioso recurso. Visita la oficina de tu maestro para hablar sobre las áreas con las que tienes problemas. Trate de hacer algunas preguntas claras y sucintas, o un problema o dos con los que tenga problemas. Prepárate para explicar el proceso de pensamiento que te llevó a la respuesta incorrecta.  2 Use herramientas para ayudar a visualizar problemas. En O chem, las formas de las moléculas pueden determinar cómo reaccionan. Debido a que puede ser difícil representar moléculas 3D complejas en una hoja de papel plana, el uso de bloques de construcción físicos es una excelente manera de envolver su cabeza en estructuras difíciles.
2 Use herramientas para ayudar a visualizar problemas. En O chem, las formas de las moléculas pueden determinar cómo reaccionan. Debido a que puede ser difícil representar moléculas 3D complejas en una hoja de papel plana, el uso de bloques de construcción físicos es una excelente manera de envolver su cabeza en estructuras difíciles.  3 Únase a la discusión en foros de ayuda. Uno de los revestimientos plateados del alto nivel de dificultad de la química O es que hay un montón de estudiantes que buscan ayuda en línea (además de ofrecerla). Varios foros de química en línea tienen grandes comunidades de usuarios dispuestos a discutir temas orgánicos difíciles. Intente publicar un problema con el que tenga problemas en uno de estos foros, luego trabaje con las personas que responden para obtener la ayuda que necesita.
3 Únase a la discusión en foros de ayuda. Uno de los revestimientos plateados del alto nivel de dificultad de la química O es que hay un montón de estudiantes que buscan ayuda en línea (además de ofrecerla). Varios foros de química en línea tienen grandes comunidades de usuarios dispuestos a discutir temas orgánicos difíciles. Intente publicar un problema con el que tenga problemas en uno de estos foros, luego trabaje con las personas que responden para obtener la ayuda que necesita.  4 Use los recursos de O chem en línea. Una amplia variedad de sitios puede ayudar con temas difíciles de O chem. A continuación se enumeran algunos buenos recursos:
4 Use los recursos de O chem en línea. Una amplia variedad de sitios puede ayudar con temas difíciles de O chem. A continuación se enumeran algunos buenos recursos: