Tanto los niños como los adultos a menudo están fascinados por la ciencia y la química. Una excelente forma de entretener a la audiencia en el aula o en casa es crear su propio hidrógeno. Tanto el agua como los ácidos contienen hidrógeno que puedes separar para formar gas de hidrógeno puro. Puede eliminar el gas de hidrógeno del agua usando electricidad. Los ácidos a veces son incluso más fáciles de usar, ya que muchos ácidos reaccionarán con metales como el aluminio y generarán hidrógeno gaseoso. Solo recuerda ser cauteloso, el gas de hidrógeno puede explotar.
Parte uno de tres:
Agua electrolizadora
-
 1 Vierta agua en un recipiente de vidrio. Evite usar plástico o metal para esto. Correrás una corriente eléctrica a través del agua que podría derretir plásticos. El metal conducirá esta corriente y podría sacudirte si tocas el contenedor.[1]
1 Vierta agua en un recipiente de vidrio. Evite usar plástico o metal para esto. Correrás una corriente eléctrica a través del agua que podría derretir plásticos. El metal conducirá esta corriente y podría sacudirte si tocas el contenedor.[1] - Si no está familiarizado con este experimento, comience con una taza de agua. Producir demasiado hidrógeno puede ser peligroso.
- Los niños solo deben hacer este experimento con un adulto responsable / conocedor.
- Agregue una cucharada de sal al agua para obtener mejores resultados: la sal ayudará a conducir la corriente eléctrica.
-
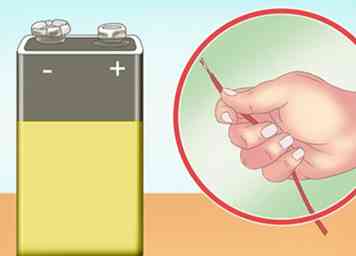 2 Ubica una fuente de poder. Si bien la producción de hidrógeno a gran escala requiere mucha energía, este experimento puede realizarse con poca información. Una batería de 9V es suficiente para realizar la electrólisis (división del agua en hidrógeno y oxígeno). También puede usar varias baterías en serie para fortalecer el efecto.[2]
2 Ubica una fuente de poder. Si bien la producción de hidrógeno a gran escala requiere mucha energía, este experimento puede realizarse con poca información. Una batería de 9V es suficiente para realizar la electrólisis (división del agua en hidrógeno y oxígeno). También puede usar varias baterías en serie para fortalecer el efecto.[2] - Una fuente de alimentación portátil es buena para este experimento, ya que este experimento debe realizarse al aire libre o debajo de una campana extractora.
- Si bien las baterías generalmente no son peligrosas, debe usar guantes de goma para evitar ser sorprendido.
- 3 Conecte un clip a cada terminal de la batería. Esto creará un ánodo (el clip de papel negativo) y un cátodo (el clip de papel positivo). Simplemente envuelva los clips de papel alrededor de los terminales de la batería hasta que estén seguros.
-
 4 Sumerge los clips de papel. Cuando sumerge los clips, la electricidad fluirá desde el ánodo, a través del agua y hasta el cátodo. Se formarán burbujas de hidrógeno en el ánodo y el cátodo producirá oxígeno y cloro gaseoso.[3]
4 Sumerge los clips de papel. Cuando sumerge los clips, la electricidad fluirá desde el ánodo, a través del agua y hasta el cátodo. Se formarán burbujas de hidrógeno en el ánodo y el cátodo producirá oxígeno y cloro gaseoso.[3] - Tenga cuidado de no tocar los clips de papel juntos.
Parte dos de tres:
Reacción de ácidos
-
 1 Coloque papel de aluminio en un vaso de precipitados. Rasgue pedazos de papel de aluminio y póngalos en un vaso de precipitados u otro recipiente. No use un recipiente con tapa o tapa, ya que podría provocar una explosión. No es necesario medir la cantidad de aluminio utilizada.[4]
1 Coloque papel de aluminio en un vaso de precipitados. Rasgue pedazos de papel de aluminio y póngalos en un vaso de precipitados u otro recipiente. No use un recipiente con tapa o tapa, ya que podría provocar una explosión. No es necesario medir la cantidad de aluminio utilizada.[4] - Podría rasgar un cuadrado de papel de aluminio de tres por tres pulgadas en piezas del tamaño de su pulgar.
-
 2 Mantenga el vaso de precipitados ventilado. Haga este experimento afuera o debajo de una campana de humos. El gas de hidrógeno se dispersa rápidamente, pero es muy inflamable. Una acumulación de gas de hidrógeno que está expuesta al aire (o a cualquier otra fuente de oxígeno) puede explotar.[5]
2 Mantenga el vaso de precipitados ventilado. Haga este experimento afuera o debajo de una campana de humos. El gas de hidrógeno se dispersa rápidamente, pero es muy inflamable. Una acumulación de gas de hidrógeno que está expuesta al aire (o a cualquier otra fuente de oxígeno) puede explotar.[5] - Un ejemplo de explosión de gas de hidrógeno es el Hindenburg.
-
 3 Agregue ácido clorhídrico. No es necesario medir con precisión la cantidad de ácido clorhídrico utilizado. El cloro en el ácido clorhídrico reaccionará con el aluminio para formar cloruro de aluminio. Esto dará como resultado la formación de gas de hidrógeno.[6]
3 Agregue ácido clorhídrico. No es necesario medir con precisión la cantidad de ácido clorhídrico utilizado. El cloro en el ácido clorhídrico reaccionará con el aluminio para formar cloruro de aluminio. Esto dará como resultado la formación de gas de hidrógeno.[6] - Comience con aproximadamente dos onzas de ácido clorhídrico y agregue más si es necesario.
Parte tres de tres:
Recolectando el Hidrógeno
-
 1 Use un globo o una botella para recoger el hidrógeno. Coloque la abertura del recipiente de recolección (botella o globo) sobre la abertura de su recipiente o recipiente de reacción. El gas de hidrógeno es menos denso que el aire y se moverá hacia arriba en su recipiente de recolección. Este método se usa a menudo para inflar un globo para demostrar el movimiento ascendente del gas de hidrógeno.[7]
1 Use un globo o una botella para recoger el hidrógeno. Coloque la abertura del recipiente de recolección (botella o globo) sobre la abertura de su recipiente o recipiente de reacción. El gas de hidrógeno es menos denso que el aire y se moverá hacia arriba en su recipiente de recolección. Este método se usa a menudo para inflar un globo para demostrar el movimiento ascendente del gas de hidrógeno.[7] -
 2 Evite recolectar hidrógeno cuando los dos clips estén liberando gas. El gas de hidrógeno puede explotar si entra en contacto con el oxígeno. Si está haciendo electrólisis, no intente recolectar hidrógeno cuando los sujetapapeles sigan emitiendo gas ya que los gases serán una mezcla de hidrógeno y oxígeno.[8]
2 Evite recolectar hidrógeno cuando los dos clips estén liberando gas. El gas de hidrógeno puede explotar si entra en contacto con el oxígeno. Si está haciendo electrólisis, no intente recolectar hidrógeno cuando los sujetapapeles sigan emitiendo gas ya que los gases serán una mezcla de hidrógeno y oxígeno.[8] -
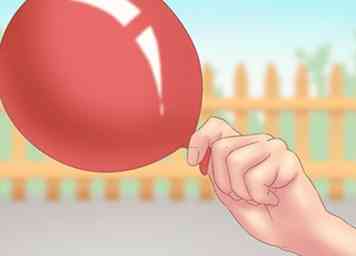 3 Recoge solo pequeñas cantidades. No debe recolectar ni almacenar un alto volumen de gas de hidrógeno. Presenta un serio riesgo de seguridad y es difícil de contener. Deberías hacer este experimento solo con fines de entretenimiento o educativos.[9]
3 Recoge solo pequeñas cantidades. No debe recolectar ni almacenar un alto volumen de gas de hidrógeno. Presenta un serio riesgo de seguridad y es difícil de contener. Deberías hacer este experimento solo con fines de entretenimiento o educativos.[9]
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Vierta agua en un recipiente de vidrio. Evite usar plástico o metal para esto. Correrás una corriente eléctrica a través del agua que podría derretir plásticos. El metal conducirá esta corriente y podría sacudirte si tocas el contenedor.[1]
1 Vierta agua en un recipiente de vidrio. Evite usar plástico o metal para esto. Correrás una corriente eléctrica a través del agua que podría derretir plásticos. El metal conducirá esta corriente y podría sacudirte si tocas el contenedor.[1]  2 Ubica una fuente de poder. Si bien la producción de hidrógeno a gran escala requiere mucha energía, este experimento puede realizarse con poca información. Una batería de 9V es suficiente para realizar la electrólisis (división del agua en hidrógeno y oxígeno). También puede usar varias baterías en serie para fortalecer el efecto.[2]
2 Ubica una fuente de poder. Si bien la producción de hidrógeno a gran escala requiere mucha energía, este experimento puede realizarse con poca información. Una batería de 9V es suficiente para realizar la electrólisis (división del agua en hidrógeno y oxígeno). También puede usar varias baterías en serie para fortalecer el efecto.[2]  4 Sumerge los clips de papel. Cuando sumerge los clips, la electricidad fluirá desde el ánodo, a través del agua y hasta el cátodo. Se formarán burbujas de hidrógeno en el ánodo y el cátodo producirá oxígeno y cloro gaseoso.[3]
4 Sumerge los clips de papel. Cuando sumerge los clips, la electricidad fluirá desde el ánodo, a través del agua y hasta el cátodo. Se formarán burbujas de hidrógeno en el ánodo y el cátodo producirá oxígeno y cloro gaseoso.[3]  1 Coloque papel de aluminio en un vaso de precipitados. Rasgue pedazos de papel de aluminio y póngalos en un vaso de precipitados u otro recipiente. No use un recipiente con tapa o tapa, ya que podría provocar una explosión. No es necesario medir la cantidad de aluminio utilizada.[4]
1 Coloque papel de aluminio en un vaso de precipitados. Rasgue pedazos de papel de aluminio y póngalos en un vaso de precipitados u otro recipiente. No use un recipiente con tapa o tapa, ya que podría provocar una explosión. No es necesario medir la cantidad de aluminio utilizada.[4]  2 Mantenga el vaso de precipitados ventilado. Haga este experimento afuera o debajo de una campana de humos. El gas de hidrógeno se dispersa rápidamente, pero es muy inflamable. Una acumulación de gas de hidrógeno que está expuesta al aire (o a cualquier otra fuente de oxígeno) puede explotar.[5]
2 Mantenga el vaso de precipitados ventilado. Haga este experimento afuera o debajo de una campana de humos. El gas de hidrógeno se dispersa rápidamente, pero es muy inflamable. Una acumulación de gas de hidrógeno que está expuesta al aire (o a cualquier otra fuente de oxígeno) puede explotar.[5]  3 Agregue ácido clorhídrico. No es necesario medir con precisión la cantidad de ácido clorhídrico utilizado. El cloro en el ácido clorhídrico reaccionará con el aluminio para formar cloruro de aluminio. Esto dará como resultado la formación de gas de hidrógeno.[6]
3 Agregue ácido clorhídrico. No es necesario medir con precisión la cantidad de ácido clorhídrico utilizado. El cloro en el ácido clorhídrico reaccionará con el aluminio para formar cloruro de aluminio. Esto dará como resultado la formación de gas de hidrógeno.[6]  1 Use un globo o una botella para recoger el hidrógeno. Coloque la abertura del recipiente de recolección (botella o globo) sobre la abertura de su recipiente o recipiente de reacción. El gas de hidrógeno es menos denso que el aire y se moverá hacia arriba en su recipiente de recolección. Este método se usa a menudo para inflar un globo para demostrar el movimiento ascendente del gas de hidrógeno.[7]
1 Use un globo o una botella para recoger el hidrógeno. Coloque la abertura del recipiente de recolección (botella o globo) sobre la abertura de su recipiente o recipiente de reacción. El gas de hidrógeno es menos denso que el aire y se moverá hacia arriba en su recipiente de recolección. Este método se usa a menudo para inflar un globo para demostrar el movimiento ascendente del gas de hidrógeno.[7]  2 Evite recolectar hidrógeno cuando los dos clips estén liberando gas. El gas de hidrógeno puede explotar si entra en contacto con el oxígeno. Si está haciendo electrólisis, no intente recolectar hidrógeno cuando los sujetapapeles sigan emitiendo gas ya que los gases serán una mezcla de hidrógeno y oxígeno.[8]
2 Evite recolectar hidrógeno cuando los dos clips estén liberando gas. El gas de hidrógeno puede explotar si entra en contacto con el oxígeno. Si está haciendo electrólisis, no intente recolectar hidrógeno cuando los sujetapapeles sigan emitiendo gas ya que los gases serán una mezcla de hidrógeno y oxígeno.[8]  3 Recoge solo pequeñas cantidades. No debe recolectar ni almacenar un alto volumen de gas de hidrógeno. Presenta un serio riesgo de seguridad y es difícil de contener. Deberías hacer este experimento solo con fines de entretenimiento o educativos.[9]
3 Recoge solo pequeñas cantidades. No debe recolectar ni almacenar un alto volumen de gas de hidrógeno. Presenta un serio riesgo de seguridad y es difícil de contener. Deberías hacer este experimento solo con fines de entretenimiento o educativos.[9]